0,01m 2,0m - ReshimNa5.ru
реклама

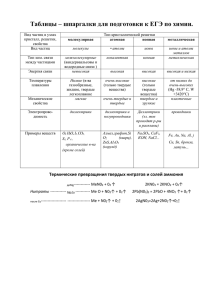
1. Вычислить тепловой эффект реакции горения ацетилена до диоксида углерода и воды, если известно, что при сгорании 10 л ацетилена (НУ) выделилось 580,74 кДж теплоты. 2. Константа равновесия реакции N2 + ЗН2 - 2NH3 равна 0,1 при 400°С и значениях равновесных концентраций, моль/л: Сн2 = 0,2: CNH3 = 0,08 Определить начальную и равновесную концентрации азота. 3. Вычислить молярную массу эквивалента двухосновной кислоты, в 12,5 н растворе которой массовая доля этой кислоты составляет 37%, а плотность раствора — 1,66 кг/л. Какая это кислота? Чему равны ее молярность и моляльность? 4. Осмотическое давление раствора, содержащего в 1 л 72 г маннита, равно 9*105 Па при 273 К. Найти формулу маннита, если массовые доли углерода, водорода и кислорода, входящие в его состав, соответственно равны, %: 39.56; 7.69; 52,75. 5. Вычислить степень диссоциации гидроксида аммония в 1 М растворе, если в 1 л его содержится 6 045*10 23 растворенных частиц. Определить рН полученного раствора 6. В каком порядке следует сливать растворы CdCl2 и Na2S. чтобы получить коллоидную систему с частицами, несущими отрицательные электрические заряды? Написать формулу мицеллы образующегося золя 7. Вычислить эдс концентрационной цепи, описываемой следующей схемой: (-) Z n | ZnS04 0,01M II ZnSO4, I Z n (+). 2,0M Составить уравнения электродных реакций, указать направление тока 8. Составить уравнение электродных реакций протекающих при электролизе раствора сульфата меди (II) г растворимым медным анодом и нерастворимым графитовым анодом. Сколько меди выделится на катоде при пропускании тока силой 10 А в течение 3 ч? 9. С какими из указанных соединений — Н20, НCl, H2S04 (разб.). H2S04 (конц). HN0 3 (разб) HN0 3 (конц.) — взаимодействуют Be и Mg? Написать уравнения соответствующих реакций.