Автор работы: Товстюк Мария Викторовна, учитель химии, МБОУ СОШ №... мурманской обл.
реклама

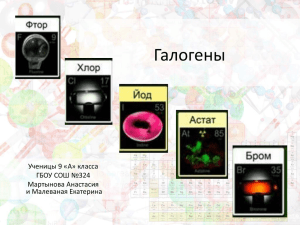
Автор работы: Товстюк Мария Викторовна, учитель химии, МБОУ СОШ № 5 , г. Мончегорска, мурманской обл. Строение галогенов ( с. 104 учебника) заполнить таблицу фтор хлор бром иод астат Заряд ядра +9 … +35 … … Аr … 35,5 … … 210 Число ē … 17 … 53 … Число p 9 … 35 … … Число n … … 45 … 125 ē формула )2 )7 )…)…)… )…)…)…)… )…)…)…)…)… )…)…)…)…)…)… Степень окисления -1, 0 -1, 0,+1,+3, +5,+7 … … … Валентност I ь I, III, V, VII … … … Формула простого вещества … … … … … Вид Фтор Хлор Бром Иод Агр. состоя ние Цвет Запах Т. пл. Т. кип. Закономерности: С увеличением Mr галогена увеличиваются: Т пл. и Т кип., плотность, радиус атома, длина связи в простом веществе и уменьшается: восстановительные свойства химическая активность Как переводится название группы «галогены»? Галогены- сильные окислители. Какие химические свойства проявляют галогены? С медью: Cu + Г2 = СuГ2 С железом : Fe + … = … C алюминием: … + … = … Фтор Хлор Бром Иод Бром Иод Медь Железо Алюминий Цинк Фтор Водород Хлор Фтор Хлор Бром Иод Вода HF + O2 - - - Фториды - - - - Хлориды Фториды + Cl2 - - - Бромиды Фториды + Br2 Хлориды +Br2 - - Иодиды Фториды + I2 Хлориды + I2 Бромиды + I2 - Какие свойства проявляют галогены в химических реакциях? Окислительные Металлические Восстановительные Окислительно- восстановительные Все перечисленное Сопоставьте ученого и открытый им галоген Шееле Муассан Бром Балар Хлор Куртуа Фтор Иод Какова степень окисления галогена в KClO4 +7 +5 +3 0 -1 Какова степень окисления галогена в HClO3 +7 +5 +3 0 -1 Схема процесса окисления в реакции : H2 + Сl2 = 2HCl Э0 → Э-1 Э-1 → Э0 Э0 → Э+1 Э+1 → Э0 Э0 → Э+3 Схема процесса восстановления в реакции : 2HBr + Сl2 = 2HCl +Br2 Э+1 → Э0 Э0 → Э-1 Э0 → Э+1 Э-1 → Э0 Э0 → Э+3 Задание Мах. баллы Табл. Строение 30 Табл. Физические свойства 20 Закономерности 4 Табл. Химические свойства с металлами 16 Табл. Химические свойства с неметаллами 4 Ученые 4 Тест 4 Фактические баллы Количество баллов Уровень Оценка 78- 82 Высокий 5 70-77 Повышенный 4 55-69 Средний 3 0-54 Низкий 2 Домашнее задание (УМК О.Габриелян)