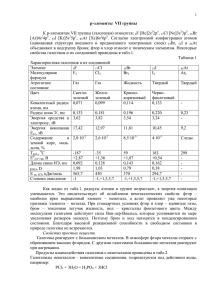
[Год] Индивидуальный Проект Пожидаевой Ксении 9А Содержание 1. Введение…………………………………………………2 2. Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе…………………………………………......3 3 . Изменение в группе величины радиусов атомов и ионов, потенциала ионизации……………………………………………………10 4. Список литературы………………………………………11 1 1.Введение Главную подгруппу элементов седьмой группы периодической системы составляют: фтор (F), хлор (Cl), бром (Br), иод (I), астат (At). На внешнем уровне у них от 1 до 7 электрона, электронные конфигурации имеют вид: nS2nP5. Они в соединениях проявляют степени окисления от –7 до +1. Сверху вниз в подгруппе металлические свойства усиливаются, а неметаллические ослабевают. Фтор – бесцветный, трудно сжижающийся газ; хлор – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; бром – жидкость красно-бурого цвета; йод – кристаллическое вещество фиолетового цвета; астат – радиоактивный кристалл темно-синего цвета. Роль этой группы элементов в жизни человека очень велика. От применения в быту до участия некоторых из них множествах биохимических реакциях организма животных и в частности человека 2 2. Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе Галоге́ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название галоиды) — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы). Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus. Физические свойства галогенов: F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета. Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается: практически постоянное равновесное количество изотопов астата. Краткая история открытий галогенов. 3 История открытия фтора непосредственно связана с минералом флюоритом, который иначе называется плавиковым шпатом. Состав этого минерала, как сейчас известно, отвечает формуле CaF2, и он представляет собой первое содержащее фтор вещество, которое когда-либо начал использовать человек. В давние времена было известно, что если флюорит добавить при выплавке металла к руде, то температура плавления руды и шлаков понижается, что значительно облегчает проведение процесса (отсюда название минерала — от лат. fluo — теку). В 1771 году обработкой флюорита серной кислотой шведский химик К. Шееле приготовил кислоту, которую он назвал «плавиковой». Французский ученый А. Лавуазье предположил, что в состав этой кислоты входит новый химический элемент, который он предложил назвать «флуорем» (Лавуазье считал, что плавиковая кислота — это соединение флуория с кислородом, ведь, по мнению Лавуазье, все кислоты должны содержать кислород). Однако выделить новый элемент он не смог. За новым элементом укрепилось название «флюор», которое отражено и в его латинском названии. Но длительные попытки выделить этот элемент в свободном виде успеха не имели. Многие ученые, пытавшиеся получить его в свободном виде, погибли при проведении таких опытов или стали инвалидами. Это и английские химики братья Т. и Г. Ноксы, и французы Ж.-Л. Гей-Люссак и Л. Ж. Тенар, и многие другие. Сам Г. Дэви, первым получивший в свободном виде натрий (Na), калий (K), кальций (Ca) и другие элементы, в результате экспериментов по получению фтора электролизом отравился и тяжело заболел. Вероятно, под впечатлением всех этих неудач в 1816 году для нового элемента было предложено хотя и сходное по звучанию, но совершенно другое по смыслу название — фтор (от греч. phtoros — разрушение, гибель). Это название элемента принято только в русском языке, французы и немцы продолжают называть фтор fluor, англичане — fluorine. Получить фтор в свободном виде не смог и такой выдающийся ученый, как М. Фарадей. Только в 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода HF, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия KF, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию 4 нового, чрезвычайно реакционноспособного газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины (Pt) и иридия (Ir). При этом каждый грамм полученного фтора «съедал» до 6 г платины. Позднее Муассан стал использовать значительно более дешевый медный электролизер. Фтор реагирует с медью (Cu), но при реакции образуется тончайшая пленка фторида, которая препятствует дальнейшему разрушению металла. Бром был открыт двадцатичетырехлетним лаборантом АнтуаномЖеромомБаларом. Балар изучал маточные рассолы южных соляных болот Франции. Во время одного из опытов, когда он подействовал на рассол хлором, он заметил появление весьма интенсивной желтой окраски, вызванной реакцией взаимодействия содержащегося в растворе бромида натрия с хлором. Через несколько лет напряженной работы Балар выделил необходимое количество темно-бурой жидкости, названной им муридом. В парижской Академии Наук Гей-Люссак и Тенар подтвердили открытие Баларом нового простого вещества, но нашли название неудачным и предложили свое- "бром", что в переводе с греческого означало зловонный. В последствии французский химик Шарль Жерар, не получивший кафедру химии во Французском колледже, которую передали Балару, высоко оценив открытие им брома, не смог удержаться от резкого восклицания: "Это не Балар открыл бром, бром открыл Балара!" 5 Открытие йода В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл йод. Друзья его рассказывают любопытные подробности этого открытия. У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около лабораторного стола. В одной бутылке Куртуа приготовил для опыта суспензию золы водорослей(содержащей йодид натрия) в этаноле, в другой находилась концентрированная серная кислота. Бутылки разбились и жидкости смешались. С пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде мельчайших черно-фиолетовых кристалликов с металлическим блеском и едким запахом. Это и был новый химический элемент йод. 6 Соединения хлора , такие как поваренная соль и нашатырь(хлорид аммония) были знакомы человеку очень давно. А первым важным соединением, которое получил человек была соляная кислота. Первое упоминание о кислоте относится к концу XVI в.(Лабавиус "Алхимия". Кислота использовалась для алхимических опытов и для ремёсел. Получали её путем перегонки смесей, в состав которых входила поваренная соль, смешанная с железным купоросом, алюмокалиевыми квасцами. Количества кислоты были незначительными. Подробное описание соляной кислоте дал Глаубер, который получил соляную кислоту реакцией между поваренной солью и серной кислотой. Есть предположение, что им также был впервые получен хлор, но пальма первенства в открытии хлора принадлежит Шееле. Он исследовал пиролюзит, который он растворял в соляной кислоте при низких температурах. Образовывался темно коричневый раствор. Он предполагал, должен был получится водород, но газ, образовавшийся при взаимодействии, совсем не был похож на водород. Шееле проводил опыты с неизвестным газом, и выявил его высокую активность. Он реагировал почти на все металлы, обесцвечивал красители, входящие в состав цветов. А при взаимодействии с аммиаком образовывался туман белого цвета В конце XVIII века многие ученые-химики, такие как Гей-Люссак и Тенар пытались найти кислород в выделившемся газе (хлоре). Дэви электролитически пытался разложить неизвестный газ используя метод электролиза, но это не удалось. Он доказал, что неизвестный газ представляет из себя элементарное вещество. Он назвал его хлорин, позднее хлором. Данный газ имеет желтозеленую окраску. В переводе на русский с греческогоChlor в буквальном смысле переводится как желто-зеленый. Астат (франц. Astate англ. Astatine, нем. Astat) - элемент подгруппы галогенов VII группы периодической системы. До своего открытия он был известен под именем, данным Менделеевым,- эка-иод (EkaIodum). Было очевидно, что элемент 85 должен обладать интересными промежуточными свойствами: с одной стороны, активностью галогенов, с другой - металлическими свойствами. Поэтому с конца XIX в. велись интенсивные поиски этого элемента в различных минералах. Несколько раз появлялись сообщения об его открытии, но эти сообщения не подтверждались. Авторы мнимых открытий давали элементу 85 разные названия: дакин 7 (Dacinum - от названия древней страны даков, соплеменников готов, в средней Европе), гельвеций (Helvetium - от старинного названия Швейцарии, Гельвеция), англогельвеций (Anglohelvetium), лептин (от греч.- слабый, шаткий, обездоленный) и др. В 1931 г. Аллисон с сотрудниками Политехнического института штата Алабама в США сообщил, что ему удалось обнаружить в растворе, извлеченном из монацитного песка с помощью магнетооптических методов, следы элемента 85, которому он дал название алабамий (Alabamium); под этим названием элемент 85 фигурировал в учебниках и справочниках до 1947 г. Реально, однако, один из изотопов элемента 85 (астат- 211) был получен лишь в 1940 г. Корсоном, Маккензи и Сегре в циклотроне, где производилась бомбардировка висмута быстрыми alfaчастицами. Период полураспада этого изотопа оказался всего 7,2 часа. Вскоре (1942 -- 1943) было установлено, что изотопы элемента 85 образуются во всех трех рядах радиоактивного распада. Элемент 85 получил свое название астат (Astatium) в 1947 г. в статье авторов открытия (Nature, 159, 24, 1947). Название произведено от греч.означающего "неустойчивый, шаткий", так как все изотопы астата оказались коротко- живущими. До недавнего времени в русской литературе элемент 85 называли астатин, что нельзя признать правильным, имея в виду слово, от которого образовано название. Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде.Все галогены в свободном состоянии – окислители. Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель. Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе. 8 В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl,сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6Н2О, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[4]). На долю хлора приходится 0,025 % от общего числа атомов земной коры;кларковое число хлора — 0,017 %. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь, он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них —бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br)[4]. Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома не может надёжно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде солёных озёр, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также 9 калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом. 3. Изменение в группах величины радиуса атомов и ионов, потенциала ионизации Если рассматривать относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром. В группах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек. У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко (в периоде атомные радиусы уменьшаются), чем у d- и f-элементов, поскольку d- и f-электроны внутренние. У dи f-элементов кривая изменения радиусов атомов по периоду имеет более плавный характер. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы. Размеры атомов следуют периодичности системы Менделеева. Исключения составляют элементы от № 57 (лантан) до №71 (лютеций), где радиусы атомов не увеличиваются, а равномерно уменьшаются (так называемое лантаноидное сжатие), и элементы от № 89 (актиний) и дальше (так называемое актиноидное сжатие). Следовательно, в IIIБ - VБ подгруппах периодической системы химических элементов Д.И. Менделеева в вертикальном направлении сверху вниз радиус атома химических элементов увеличивается, за исключением лантана, актиния и проактиния. В группах (в подгруппах s- и p-элементы) сверху вниз энергия ионизации уменьшается. Это обусловлено увеличением радиусов 10 атомов: чем больше размер атома, тем легче от него оторвать электрон, тем меньше значение энергии ионизации. В подгруппах d-элементов, кроме подгруппы скандия (IIIБ), как правило, сверху вниз повышается Повышение энергии ионизации в подгруппах d-элементов вызвано эффектом проникновения электронов к ядру. Согласно квантовой теории внешние электроны проникают ближе к ядру под dподуровень. Это приводит к повышению прочности связи внешних электронов с ядром. 11 4.Список использованной литературы: 1. Н.Л. Глинка. Общая химия. Л.: Химия, 1979 2. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд; Под.ред. Ю.А. Ершова. – 10-е изд., перераб. и доп. – М.: Изд-во Юрайт, 2014. – 560 с. – Серия: Бакалавр. Базовый курс Интернет-ресуры: 1. http://ru.wikipedia.org 2. http://medical-diss.com 3. http://www.pamba.ru 12