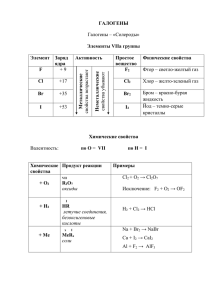
Галогены - это четыре элемента VIIА группы: фтор, хлор, бром и иод. Общая характеристика Все галогены обладают электронной конфигурацией ns2np5, т.е. до конфигурации благородного газа им не хватает всего одного электрона. Следовательно, все они являются типичными неметаллами. При движении вниз по подгруппе от фтора к иоду возрастает радиус атома, уменьшается э.о., ослабевают неметаллические свойства и окислительная способность. Каждый из галогенов имеет по семь валентных электронов, но фтор как самый сильный неметалл в периодической таблице имеет только две степени окисления: 0 (в F2) и -1 во всех своих соединениях. Для остальных характерны нечетные с.о.: -1, +1, +3, +5 и +7. Физические свойства простых веществ и нахождение в природе. Простое вещество 𝐹2 𝐶𝑙2 𝐵𝑟2 𝐼2 Состояние при стандартных условиях Газ бледно-желтого цвета Газ желто-зеленого цвета Густая бурая жидкость Кристаллическое вещество темно-серого цвета с фиолетовым отливом Температура плавления (𝑻пл ), oC Температура кипения (𝑻кип ) , oC -219.6 -188.1 -101.0 -34.1 -7.2 59.2 113.6 185.5 В воде ограниченно растворимы хлор и бром, нерастворим иод; фтор воду разлагает (вода во фторе горит!). В неполярных растворителях галогены растворяются хорошо. Все галогены кристаллизуются в молекулярной решетке; иод возгоняется с образованием паров интенсивного фиолетового цвета. В природе в свободном виде не встречаются, только в виде солей в земной коре и галогенидионов в морской воде. Хлор очень ядовит; во время I Мировой войны применялся как боевой отравляющий газ. Применение Фтор используют как окислитель в ракетных топливах, для получения различных производных углеводородов; например, тетрафторэтилена для производства тефлона или фреонов (хладагентов). Фториды используются в зубных пастах. Области применения хлора разнообразны: очистка воды, отбеливание тканей, производство соляной кислоты, хлорирование органических соединений для производства пластмасс и волокон. Общее потребление хлора мировой химической промышленностью исчисляется миллионами тонн. Бром и иод используются в медицинской промышленности. Получение простых веществ Лабораторные способы получения хлора, брома и иода сводятся к окислению галогенид-ионов в составе кислот (HCl, HBr, HI) и их солей различными окислителями: 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O 6KBr + K2Cr2O7 + 7H2SO4 → 3Br2 + 4K2SO4 + Cr2(SO4)3 + 7H2O Промышленные способы получения фтора и хлора связаны с электролизом. Фтор получают исключительно электролизом расплавов (почему?), а хлор – как расплавов, так и растворов хлоридов: 2NaCl + 2H2O → H2 + 2NaOH + Cl2 В качестве сырья используют поваренную соль как самое распространенное и дешевое природное соединение хлора. Бром и иод получают вытеснением из бромидом и иодидов хлором (см.ниже). Химические свойства Галогены – сильные неметаллы, типичные окислители. Они вступают в реакцию даже с теми металлами, которые не окисляются кислородом – серебром, золотом: 2Au +I2 → 2AuI. Галогены взаимодействуют с неметаллами: кремнием (SiHal4), фосфором (PНal3 или PНal5), серой (различные галогениды, например, SF6), водородом, однако в реакцию с углеродом и азотом вступает только фтор при нагревании: 3F2 + N2 → 2NF3 2F2 + C → CF4 Хлорирование водорода, как и хлорирование алканов, по механизму относится к свободнорадикальным цепным реакциям: Кислород напрямую с галогенами кроме фтора не соединяется. Взаимодействие галогенов с простыми веществами представлены в таблице ниже: Реагент Фтор Бром Иод Не взаимодействуют. He, Ne, Ar Kr, Xe Хлор ЭFn , n = 2,4,6. Не взаимодействуют. XF (X=Cl, Br, I); BrCl, ICl, IBr XF3 (X=Cl, Br, I); I2Cl6 XF5 (X=Cl, Br, I) XF7 (X=I) Галогены О2 OF2, F2O2 (в электр.разряде) S SF6, S2F10 N2 NF3 Не взаимодействуют! C CF4 Не взаимодействуют! P PХ3 и РХ5 H2 Со взрывом в темноте Не взаимодействуют! S2Cl2, SCl2, SCl4 S2Br2 (X = F, Cl, Br) Со взрывом на Реагирует выше 2000С; свету. Pt-катализатор Не реагирует. PI3, P2I4, PI5(?) Равновесие H2+I2 2НI смещено влево Щелочные Ме МeF MeCl MeBr MeI Al AlF3 AlCl3 AlBr3 AlI3 Fe FeF3 FeCl3 FeBr3 FeI2 Cu CuF2 CuCl2 CuBr2 CuI Вытеснительный ряд. В водных растворах идут окислительно-восстановительные реакции вытеснения: хлор вытесняет бром и иод из водородных кислот и бромидов и иодидов; бром вытесняет иодиды: Cl2 > Br2 > I2 Cl2 + 2KBr 2 KCl + Br2 Эти реакции идут только в водных растворах, поэтому фтор в них участвовать не может. В атмосфере фтора при комнатной температуре горят вода и песок: SiO2 + 2F2 → SiF4 + O2 Фтор необратимо разлагает воду с образованием атомарного кислорода: F2 + H2O 2HF + O, который затем ведет вторичные реакции с образованием O2, O3, F2O, H2O2, F2O2. Фтор особым образом реагирует с щелочами; в концентрированных растворах щелочей: F2 + 2NaOH = O2 + 2NaF + H2O Хлор и бром обратимо взаимодействуют с водой (см.ниже), причем бром – в гораздо меньшей степени. Иод с водой не взаимодействует. Химические свойства хлора. а) Реагирует с со всеми металлами (металлы горят в хлоре): Cu + Cl2 → CuCl2 Железо окисляется хлором до +3: 2Fe + 3Cl2 → 2FeCl3; (в соляной кислоте – до +2: Fe + 2HCl → FeCl2 + Н2) б) Реагирует со многими неметаллами. Например в избытке хлора образуется пентахлорид фосфора: 2P + 5Cl2 → 2PCl5 (PCl3 - при недостатке). в) Хлорная вода (раствор хлора) представляет из себя сложную систему, т.к. обратимо образует при растворении две кислоты, соляную и слабую хлорноватистую: Cl2 + H2O HCl + HСlO Равновесие здесь сдвинуто влево, т.е. большая часть хлора в растворе присутствует в виде Cl2. г) Взаимодействие хлора с раствором щелочи идет по-разному в зависимости от температуры раствора: С известковой водой хлор реагирует с образованием хлорной извести, которую можно рассматривать и как смесь хлорида и гипохлорита кальция, а можно записать как смешанную соль: Ca(OH)2 + Cl2 → (Ca(ClO)2 + CaCl2) Ca(ClO)Cl (или СаOCl2) + H2O Ca2+ ClO- ClВ молекуле хлорной извести два атома хлора в разных с.о.: -1 и +1. За счет последнего она проявляет свойства сильного окислителя, переходя в хлорид кальция: Ca(ClO)Cl + 2HCl → CaCl2 + Cl2 + H2O Водородные соединения галогенов (галогеноводороды) HF, HCl, HBr, HI. В исходном состоянии – бесцветные газы с резким запахом, прекрасно растворимые в воде. Получение 1. Прямой синтез из элементов. Фтор и хлор реагируют с водородом со взрывом. Реакция хлора с водородом является основным промышленным способом получения HCl. Бром и иод реагируют с водородом более спокойно, однако выход невелик, поскольку равновесие Н2 + Х2 ⇄ 2НХ (Х = Br, I) смещено влево. 2. В лаборатории HF и HCl получают действием концентрированной серной кислоты на твердые фториды и хлориды (в растворе реакция не пойдет. Почему?): NaCl + H2SO4 конц → HCl + NaHSO4 (допустимо Na2SO4), HBr и HI действием серной кислоты получить нельзя, т.к. бромид- и иодид-ионы концентрированной серной кислотой окисляются. Окисления HBr и HI можно избежать, заменив серную кислоту на ортофосфорную, которая тоже нелетуча, но в отличие от серной не проявляет окислительных свойств: NaHal + H3PO4 конц → Na2HPO4 + HHal↑, Hal = F, Cl, Br, I. В водных растворах галогеноводороды являются кислотами; первые две имеют тривиальные названия (плавиковая и соляная), остальные – бромо- и иодоводородные. Из четырех кислот только плавиковая (несмотря на свои особые свойства!) – слабая, остальные сильные. Фториды, следовательно, гидролизуются по аниону. Сила кислот в порядке возрастания: HF HCl HBr HI, т.е. самая сильная кислота – иодоводородная. Плавиковая кислота обладает способностью растворять кварц (или стекло), поэтому с ней нельзя работать в стекляной посуде, что объясняется образованием устойчивых фторидных комплексов: SiO2 + 6HF → H2[SiF6] + 2H2O. Иодид-ионов такие сильные восстановители, что окислителями могут выступать соединения меди(II) и железа(III): 2Fe(OH)3 + 6HI →2FeI2 + I2 + 6H2O CuCl2 + NaI → I2 + NaCl + CuCl Надо помнить цвета галогенидов серебра: AgF (единственная растворимая соль) – бесцветный раствор, AgCl – белый творожистый осадок, AgBr – желтоватый осадок, AgI - ярко-желтый осадок, PbCl2 – белый осадок, PbBr2 – белый осадок, PbI2 - ярко-желтый осадок. При действии на хлорид серебра иодоводородной кислоты цвет осадка меняется с белого на желтый: AgCl + HI → AgI + HCl Эта реакция доказывает, что иодоводородная кислота сильнее соляной. Кислородсодержащие кислоты (соли) хлора. В этих соединениях хлор имеет положительные степени окисления (+1, +3, +5, +7). Необходимо знать названия кислот и их солей: HClO хлорноватистая (соли – гипохлориты), HClO2 HClO3 HClO4 хлористая (хлориты), хлорноватая (хлораты), хлорная (перхлораты). Первые две кислоты относятся к слабым (их соли гидролизуются по аниону), вторые две – к сильным. Эти кислоты и их соли проявляют окислительное действие, причем сила кислот и их окисляющая способность идут в разных направлениях: сила кислоты HClO -- HClO2 -- HClO3 -- HClO4 окисляющая способность Промышленное значение имеет хлорат калия (бертолетова соль), используемый в производстве спичек. Необходимо знать реакции его термического разложения. В присутствии оксида марганца (II) как катализатора реакция идет при сравнительно невысокой температуре с выделением кислорода: MnO2 KClO3 → KCl + O2 Если проводить реакцию без катализатора при t ~ 400ºC, реакция идет иначе: KClO3 → KCl + KClO4