Кондуктометрическое титрование
реклама

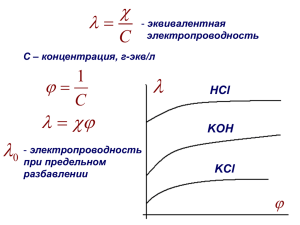
Кафедра биоорганической и биологической химии Бионеорганическая химия I КУРС ТЕМА: Основы электрохимии. Электропроводность растворов электролитов ЛЕКЦИЯ №6 ЛЕКТОРА: ПРОФЕССОР А.Д.ДЖУРАЕВ ПРОФЕССОР У.А. БАЛТАБАЕВ ПРОФЕССОР С.С. КАСЫМОВА ДОЦЕНТ Ш.У.АБДУЛЛАЕВ Цель лекции Биологические жидкости организма человека, в качестве электролитов или неэлектролитов в определённой степени проводят электрический ток и могут рассматриваться в качестве электролитов 2-го рода. Для их изучения необходимо знать понятия сопротивления, электропроводности и др. и изучить из взаимосвязь друг с другом. Рассматриваемые вопросы Основы электрохимии, теоретические основы, характеризующие способность веществ проводить электрический ток Факторы, определяющие электрическую проводимость электролитов Способы определения степени и константы диссоциации растворов электролитов путём использования значения электропроводимости Кондуктометрическое титрование Основы электрохимии Любое тело, проводящее электрический ток называется проводником. В проводниках 1-го рода электрический ток возникает только за счёт движения электронов: металлы, сплавы металлов, уголь, графит и другие. В проводниках 2-го рода или их ещё называют электролитами прохождение электрического тока сопровожается химическими изменениями: растворы солей, кислот, оснований, расплавы растворимых оксидов металлов. Электропроводность растворов электролитов Способность проводить называется растворов электролитов электрический ток сопротивлением или электропроводностью. Сопротивление: L R = ------- ; ом S Электропроводность 1 J = ------ ом-1 или Сm (сименс) R Электропроводность растворов электролитов 1 S J = ------ ----- , ом L (1/) = æ S J= æ ------ ом-1 или Сm L Удельная электропроводность (æ) 1 L æ = ------ -----, R S ом-1 см-1 Электропроводность растворов электролитов L/S = К K æ = ----, Ом-1 см-1 R Молярная электропроводность æ 1000 = ------------ Oм-1 см2 моль-1 C Определение электролитов методом кондуктометрии = К ; Ом-1 см2 моль-1 если = 1, то = К и достигает значения , т.е. = . т.к. и и К равны , то К можно заменить на , в результате: = oм-1 см2 моль-1. Отсюда: - степень диссоциации = ------ ; - молярная электропроводность - электропроводность при бесконечном разведении Определение K дисс. электролитов методом кондуктометрии C 2 K= ------- 1- или C 2 K = ---------------- (- ) Закон Кольрауша = k+ a Кондуктометрическое титрование Титрование сильной кислоты сильным основанием æ HCl +NaOH т.э. V NaOH,мл Кондуктометрическое титрование Титрование слабой кислоты сильным основанием æ CH3COOH + NaOH т.э. V NaOH,мл Кондуктометрическое титрование Титрование смеси сильной и слабой кислот сильным основанием æ HCl + CH3COOH + NaOH т.э.1 т.э.2 V NaOH,мл