V(NaOH)
реклама
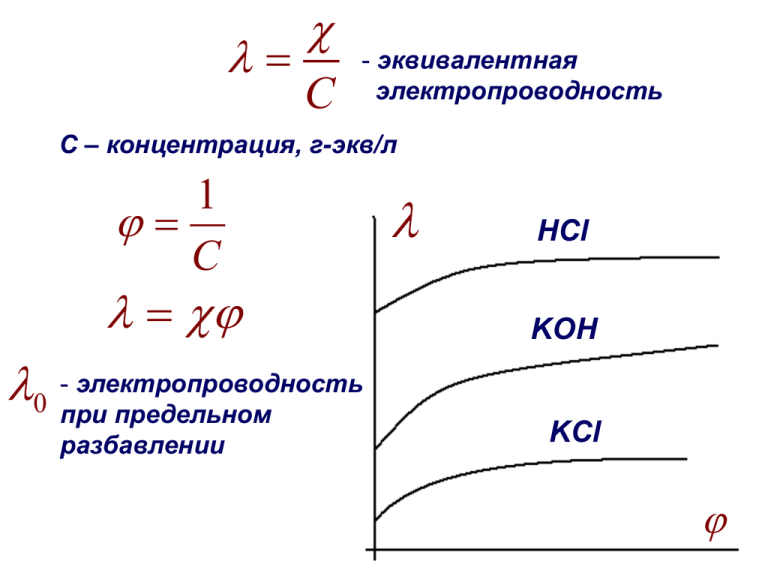
C - эквивалентная электропроводность С – концентрация, г-экв/л 1 C электропроводность 0 -при предельном разбавлении HCl KOH KCl Для сильных электролитов: 0 а С Закон Кольрауша: подвижность ионов данного типа в бесконечно разбавленном растворе не зависит от природы других ионов, присутствующих в растворе Для слабых электролитов: FU 0 l l FU t 18 (1 a (t 18)) Определение электропроводности R1 R3 R2 RX R3 R2 RX R1 1 R Rx R1 R3 R2 Определение константы диссоциации 0 C Kд 1 2 C Kд 0 (0 ) 2 C K 2 д 0 a K 2 0 C а 1 K д 0 b K 0 1 b Кондуктометрическое титрование NaOH + HCl NaCl + H2O V(NaOH) Титрование смеси кислот НА и НВ. 2 1 V(NaOH) 1. NaOH + HА NaА + H2O 2. NaOH + HВ NaВ + H2O Подвижность ионов воды. 0 ( H 2O) 0 (в в) 0 l l lН (315) lOН (174) lK (64, 6) + l1/ 2CO2 (70) 3 - Н Н О: О: Н Н Н Н О: Н О: Н Электродные потенциалы. ЭДС. Металл Электролит + + + + + + + + d Двойной электрический слой Гальванический элемент е е + Металл 1 - АК+ Металл 2 Электролит электроны Соляной мостик - катод анод Ме1 + Ме2 Электролит 2 Электролит 1 Анод: Катод: n 1 Me1 ne Me n 2 Me ne Me2 E M 2 M1 2 H / Н2 -0,763 -0,403 Zn2+/Zn Cd2+/Cd окисление RT 0 ln a nF M M 2 0 0 0,337 2H+/H2 Cu2+/Cu восстановление - уравнение Нернста 1