Обмен липидов -2
реклама

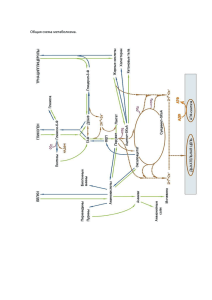
ОБМЕН ЛИПИДОВ-2 План • 1. Биосинтез жирных кислот и его регуляция • 2. Биосинтез ацетоуксусной кислоты и физиологическое значение как ключевого метаболита. • 3. Стероиды их разновидности. Холестерин, его строение и значение для организма. • 4. Биосинтез холестерина и его регуляция. Транспорт холестерина в крови, биохимические механизмы атеросклероза. • 5. Основные фосфолипиды, гликолипиды и их функции. • 6. Биосинтез фосфолипидов и их катаболизм. Биосинтез жирных кислот • В основном протекает в жировой ткани, молочных железах и печени. В отличие от окисления жирных кислот: • Протекает в эндоплазматическом ретикулуме • Источником синтеза является малонил КоА • Для восстановления промежуточных продуктов синтеза жирных кислот необходим НАДФН2 • Ацетил КоА используется как затравка • Все стадии синтеза жирных кислот представляют собой циклический процесс, протекающий на поверхности пальмитатсинтетазы АПБ Расположен в центре пальмитатсинтетазы и имеет 2 SНгруппы: 1. центральная, связанная с 4фосфопантотенатом (присоединение малонил-КоА) 2. Периферическая, принадлежащая остатку цистеина (присоединение ацетил-КоА) Синтез жирных кислот протекает в 3 этапа: • 1. Перенос ацетил-КоА из митохондрий в цитоплазму. • 2. Карбоксилирование ацетил-КоА с образованием малонил-КоА. • 3. Образование ацетил-АПБ и малонилАПБ, их конденсация и синтез пальмитиновой кислоты. • В состав пальмитатсинтетазы входят: АПБ и 6 ферментов. • 1. ацетилтрансацилаза • 2. малонилтрансацилаза • 3. бета-кетоацилсинтетаза • 4. бета-кетоацилредуктаза • 5. гидроксиацилгидратаза • 6. еноилредуктаза Перенос ацетил-КоА из митохондрий в цитоплазму • Коферментом ацетил-КоА -карбоксилазы является биотин. • Биотин-фермент + СО2 + АТФ → карбоксибиотинфермент + АДФ + Фн • Карбоксибиотинфермент + ацетил-КоА → малонил-КоА + биотинфермент • Ацетил-КоА + АПБ →ацетил-АПБ + КоАSH • ацетилтрансацилаза • Малонил-КоА + АПБ → малонил-АПБ + КоАSH • малонилтрансацилаза Биосинтез жирных кислот • НООС-СН2-CО-S-АПБ + СН3-CО-SАПБ→ СН3-CО-СН2-CО-S-АПБ + СO2 (ацетоацетил-S-АПБ) • Феремент:бета-кетоацилсинтетаза • ↓ + NADPH, - NADP СН3-CH(ОH)-СН2-CО-S-АПБ – бетакетоацилредуктаза • (3-гидроксибутирил-АПБ) ↓ -Н2О - гидроксиацилгидратаза • СН3-CH=СН-CО-S-АПБ (кротонил-АПБ) ¯ ↓ + NADPH, - NADP - еноилредуктаза • СН3-CH2-СН2-CО-S-АПБ (бутирил-АПБ) Регуляция синтеза жирных кислот • Ацетил-КоА-карбоксилаза является регуляторным ферментом. • Высокие концентрации АТФ блокируют ИЦДГ, что приводит к накоплению цитрата, являющегося активатором синтеза жирных кислот, пальмитин-КоА - ингибитором. • НАДФ.Н – высокие концентрации стимулируют синтез и блокируют ПФЦ окисления глюкозы • Удлинение углеродной цепи жирных кислот в наружной мембране митохондрий за счет ацетил-КоА и в мембранах эндоплазматического ретикулума за счет малонил-КоА. • Мононенасыщенные жирные кислоты (пальмитоолеиновая и олеиновая кислоты) образуются из пальмитиновой и стеариновой кислот в микросомальной фракции печени и жировой ткане при участие О2, НАДФ.Н и цитохрома b5. Биосинтез ацетоуксусной кислоты • К кетоновым телам относятся: ацетоацетат, бета-гидроксибутират, ацетон. • В основном протекает в печени. • Синтезируется 2 путями: • 1. В незначительных количествах в конечном этапе β-окисления жирных кислот образуется из 4 углеродных атомов. • 2. В основном синтезируется путем конденсации 2 молекул ацетил-КоА при участие фермента ацетоацетилтрансферазы: • Ацетил-КоА+Ацетил-КоА → Ацетоацетил-КоА + НSКоА Деацилирование протекает путем: • Ацетоацетил-КоА + Ацетил-КоА → • β-окси- β-метилглутарил-КоА → ацетоацетат + ацетил-КоА (ферменты: гидроксиметилглутарил-КоА-синтетаза и гидроксилетиглутарил-КоА-лиаза) • При восстановление ацетоацетата образуется β-окси-масляная кислота (гидроксибутиратдегидрогеназа, НАДФ.Н). • При декарбоксилирование ацетоацетата образуется ацетон (ацетоацетатдекарбоксилаза) • Кетоновые тела в периферических тканях используются в качестве энергетического материала. СТЕРОИДЫ • Из холестерина в организме синтезируются: • 1. стероидные гормоны • 2. витамин Д3 • 3. желчные кислоты • Холестерином богаты: нервная ткань, надпочечники, печень, плазматическая мембрана • Синтез холестерина протекает в печени, стенке кишечника, подкожно-жировой клетчатке, корковом слое надпочечников. • Общее содержание холестерина в организме составляет в среднем 140-150 г, из них приблизительно 10г – в крови. • За 1 сутки в организме синтезируется 1г холестерина, 0,5г – поступает с пищей. Выводится из организма в виде в виде стеридов - приблизительно 500мг с фекалиями. Основные этапы синтеза холестерина • • • • 1. Ацетил-КоА → мевалоновая кислота 2. Мевалоновая кислота → сквален 3. Сквален → ланостерин 4. Ланостерин → холестерин Образование мевалоновой кислоты • Конденсация 2 молекул ацетилКоА – ацетоацетилКоА (ацетоацетилтрансфераза) • Присоединение 3 молекулы ацетилКоА – бета-гидроксиметилглутарилКоА (гидроксиметилглутарилКоА-синтетаза) • Восстановление до мевалоновой кислоты (2 НАДФ.Н и бетагидроксиметилглутарилКоА-редуктаза) Регуляция синтеза холестерина • Регуляция осуществляется через ГМГ-КоА редуктазу. • Синтез холестерина имеет суточный ритм: • В ночное время синтез его больше, чем в утреннее. • Инсулин и тиреоидные гормоны активизируют ГМГ-КоА редуктазу. • При голодание, тиреоидэктомии, введении глюкагон и глюкокортикоидов активность ГМГ-КоА редуктазы снижается. • Эфиры холестерина образуются путем присоединения остатка жирной кислоты с ацилКоА или ФХ на гидроксильную группу холестерина при участие фермента ЛХАТ Баланс холестерина в тканях • Повышение: 1. Захват холестерол-содержащих ЛП специальными рецепторами 2. Захват холестерол-содержащих ЛП без участия рецепторов 3. Захват свободного холестерина клеточными мембранами 4. Синтез холестерина 5. Гидролиз холестерина • Снижение: 1. Переход холестерина из мембраны в ЛПВП 2. Этерификация холестерина 3. Использование холестерина для синтеза гормонов, желчных кислот и витамина Атеросклероз • • • • • • • • • • • Теории: 1. Инфильтративная теория А.А. Аничкова. 2. Нервно-метаболическая теория А.А. Мясникова 3. Геронтологическая теория И.В. Давыдовского. 4. Аутоиммунная теория Климова и Блюменталя 5. Перекисная теория A. Szceklik 6. Инкрустиционная теория French 7. Роль микроэлементов 8. Роль оксида азота 9. Инфекционная теория 10. другие Основные постулаты коррекции нарушений обмена ЛП: • 1. Уменьшение приема жиров до 10% • 2. Уменьшение приема насыщенных жирных кислот • 3. Обогащение пищи полиненасыщенными жирными кислотами • 4. Увеличение содержания клетчатки в рационе питания • 5. Замена маргарина, различных видов сала и жиров растительными • 6. Уменьшение приема продуктов, содержащих холестерин • 7. Уменьшение приема поваренной соли Факторы, способствующие развитию атеросклероза: • 1. Установленные • - дислипопротеинемия, гиперхолестеринемия, гипертриглицеридемия, гипо-альфалипопротеинемия, артериальная гипертония, курение • 2. Предполагаемые • - сахарный диабет, эмоциональный стресс, наследственность • 3. Вероятные • - ожирение, гиподинамия ФОСФО- И ГЛИКОЛИПИДЫ • Фосфолипиды не являются энергетическим материалом. • Фосфолипиды участвуют в построение клеточных мембран и в выполнении функций, активизации мембранных и лизосомальных ферментов, передаче нервных импульсов, свертывание крови, иммунологических реакциях, пролиферации клеток, регенерации тканей, переносе электронов в дыхательной цепи. Они играют важную роль в формировании липопротеидных комплексов. • Синтез фосфолипидов протекает в печени, стенке кишечника, половых и молочных железах и в других тканях. • В биосинтезе фосфолипидов центральное место занимают: 1,2-диглицерид, фосфатидная кислота и сфингозин. Синтез фосфолипидов ФК + ЦТФ – ЦДФ-диацилглицерид ЦДФ-ДГ + серин – ФС ЦДФ-ДГ + инозит – ФИ ФС декарбоксилирование – ФЭА ФС метилирование (аденозилметионин, ТГФК и метилкобаламин) – ФХ Холин + ЦТФ – ЦДФ-холин ЦДФ-холин + ДГ - ФХ 1. 2. 3. 4. 5. • ФЛ с помощью липидпереносящих белков цитоплазмы переносятся к мембранам и встраиваются. • Липотропные факторы: холин, ЦТФ, серин, инозит, пиридоксальфосфат, фолиевая кислота, метионин