Митохондриальные антигены М2 IgG (Anti
реклама
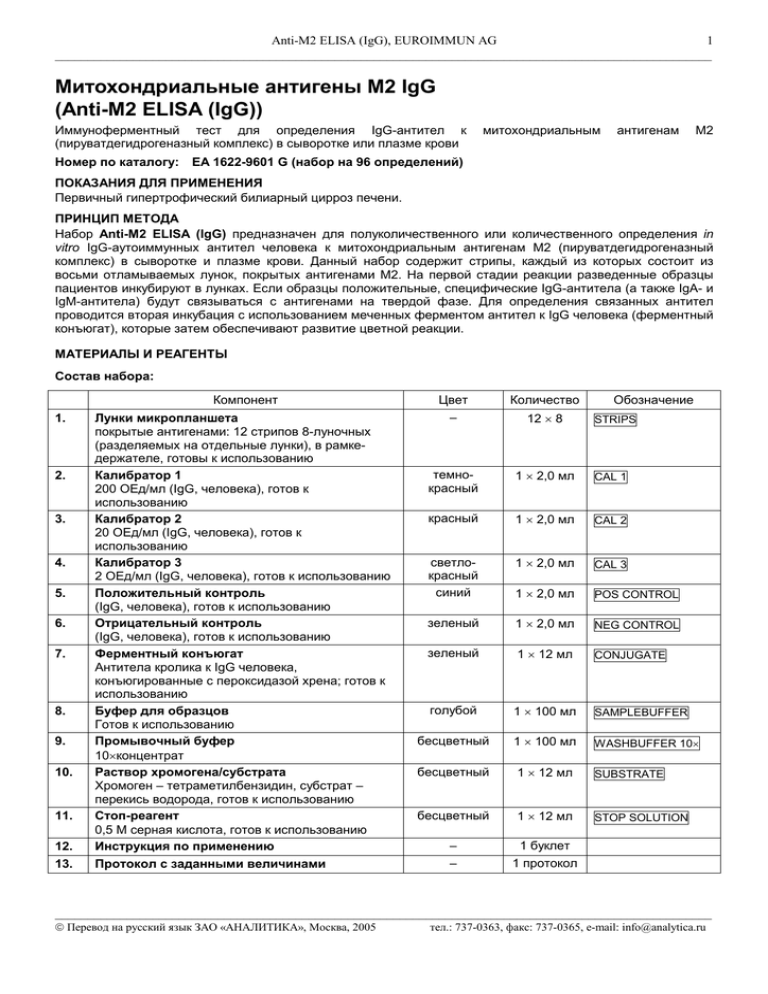
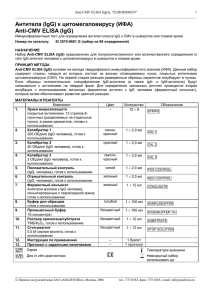
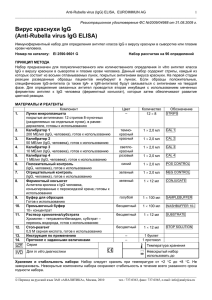
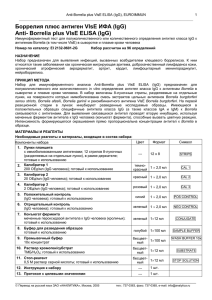
Anti-M2 ELISA (IgG), EUROIMMUN AG 1 _____________________________________________________________________________________________________ Митохондриальные антигены М2 IgG (Anti-M2 ELISA (IgG)) Иммуноферментный тест для определения IgG-антител к (пируватдегидрогеназный комплекс) в сыворотке или плазме крови Номер по каталогу: митохондриальным антигенам М2 ЕА 1622-9601 G (набор на 96 определений) ПОКАЗАНИЯ ДЛЯ ПРИМЕНЕНИЯ Первичный гипертрофический билиарный цирроз печени. ПРИНЦИП МЕТОДА Набор Anti-М2 ELISA (IgG) предназначен для полуколичественного или количественного определения in vitro IgG-аутоиммунных антител человека к митохондриальным антигенам М2 (пируватдегидрогеназный комплекс) в сыворотке и плазме крови. Данный набор содержит стрипы, каждый из которых состоит из восьми отламываемых лунок, покрытых антигенами М2. На первой стадии реакции разведенные образцы пациентов инкубируют в лунках. Если образцы положительные, специфические IgG-антитела (а также IgA- и IgM-антитела) будут связываться с антигенами на твердой фазе. Для определения связанных антител проводится вторая инкубация с использованием меченных ферментом антител к IgG человека (ферментный конъюгат), которые затем обеспечивают развитие цветной реакции. МАТЕРИАЛЫ И РЕАГЕНТЫ Состав набора: Компонент 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Лунки микропланшета покрытые антигенами: 12 стрипов 8-луночных (разделяемых на отдельные лунки), в рамкедержателе, готовы к использованию Калибратор 1 200 ОЕд/мл (IgG, человека), готов к использованию Калибратор 2 20 ОЕд/мл (IgG, человека), готов к использованию Калибратор 3 2 ОЕд/мл (IgG, человека), готов к использованию Положительный контроль (IgG, человека), готов к использованию Отрицательный контроль (IgG, человека), готов к использованию Ферментный конъюгат Антитела кролика к IgG человека, конъюгированные с пероксидазой хрена; готов к использованию Буфер для образцов Готов к использованию Промывочный буфер 10×концентрат Раствор хромогена/субстрата Хромоген – тетраметилбензидин, субстрат – перекись водорода, готов к использованию Стоп-реагент 0,5 М серная кислота, готов к использованию Инструкция по применению Протокол с заданными величинами Цвет – Количество темнокрасный 1 × 2,0 мл CAL 1 красный 1 × 2,0 мл CAL 2 светлокрасный синий 1 × 2,0 мл CAL 3 1 × 2,0 мл POS CONTROL зеленый 1 × 2,0 мл NEG CONTROL зеленый 1 × 12 мл CONJUGATE голубой 1 × 100 мл SAMPLEBUFFER бесцветный 1 × 100 мл WASHBUFFER 10× бесцветный 1 × 12 мл SUBSTRATE бесцветный 1 × 12 мл STOP SOLUTION – – 1 буклет 1 протокол 12 × 8 Обозначение STRIPS _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru Anti-M2 ELISA (IgG), EUROIMMUN AG 2 _____________________________________________________________________________________________________ Хранение и стабильность набора: Набор следует хранить при температуре от +2 °С до +8 °С. Не замораживать. Невскрытые компоненты набора сохраняют стабильность в течение всего указанного срока годности набора. Удаление отходов: Образцы пациентов, калибраторы, контроли и стрипы после инкубации следует рассматривать как инфицированные отходы и обращаться с ними соответствующим образом. Все реагенты следует удалять в соответствии с действующими официальными инструкциями. ПОДГОТОВКА И СТАБИЛЬНОСТЬ РЕАГЕНТОВ Примечание: Перед использованием температуру всех реагентов необходимо довести до комнатной (от +18 °С до +25 °С) в течение 30 минут. После первого использования реагенты сохраняют стабильность в течение указанного срока годности, если они хранятся при температуре от +2 °С до +8 °С и защищены от микробного загрязнения. Прочие сведения о стабильности отдельных реагентов указаны ниже. - Лунки, покрытые антигенами: Готовы к использованию. Откройте застежку защитной упаковки микропланшета. Во избежание конденсации влаги внутри лунок, не вскрывайте упаковку до тех пор, пока она не нагреется до комнатной температуры. Отломив необходимое количество лунок, остальные неиспользованные лунки немедленно верните в ту же упаковку и плотно закройте ее на застежку (не вынимайте из упаковки пакетик с осушителем). После того, как упаковка была вскрыта, неиспользованные лунки с антигенами в ней можно хранить минимум 4 месяца в сухом месте при температуре от +2 °С до +8 °С. - Калибраторы и контроли: Готовы к использованию. Тщательно перемешать перед использованием. - Ферментный конъюгат: Готов к использованию. Тщательно перемешать перед использованием. - Буфер для образцов: Готов к использованию. - Промывочный буфер: Поставляется в виде 10-кратного концентрата. Если образовались кристаллы, перед разведением буфера их необходимо растворить, нагревая концентрат до 37°С и интенсивно взбалтывая. Необходимое количество концентрата следует отобрать из бутыли чистой пипеткой и растворить деионизированной или дистиллированной водой (1 часть концентрированного реагента плюс 9 частей воды). Например, для проведения анализа в 1 стрипе: к 5 мл концентрата следует добавить 45 мл воды. о Готовый разведенный промывочный буфер стабилен до 4 недель, если его хранят при температуре от +2 С о до +8 С и правильно используют. - Раствор хромогена/субстрата: Готов к использованию. После отбора необходимого количества реагента из флакона немедленно вновь закройте его, так как раствор чувствителен к свету. Во время использования раствор хромогена/субстрата должен быть бесцветным. Не используйте раствор, если он приобрел голубую окраску. - Стоп-реагент: Готов к использованию. Предостережение: Используемые контрольные сыворотки были проверены на антитела к ВИЧ-1 и ВИЧ-2 и вирусу гепатита С, а также на наличие HBsAg методами иммуноферментного анализа и иммунофлуоресценции и показали отрицательные результаты. Тем не менее, все используемые материалы следует считать потенциально опасными и обращаться с ними, соблюдая необходимые меры предосторожности. Некоторые реагенты содержат токсичный азид натрия. Избегайте его попадания на кожу. ПОДГОТОВКА И СТАБИЛЬНОСТЬ ОБРАЗЦОВ ПАЦИЕНТОВ Материал образцов: Сыворотка или плазма (ЭДТА, гепарин или цитрат) крови человека. Стабильность: Образцы пациентов, предназначенные для исследования этим методом, можно хранить до о о 14 дней при температуре от +2 С до +8 С. Разведенные образцы необходимо использовать в течение одного рабочего дня. Разведение образцов: Образцы пациентов разводят 1:201 буфером для образцов. Например: разведите 5 мкл сыворотки в 1,0 мл буфера для образцов и тщательно перемешайте на вортексе (пипетки для этого не подходят). ПРИМЕЧАНИЕ: Калибраторы и контроли готовы к использованию, их разводить не надо. ПРОЦЕДУРА ИССЛЕДОВАНИЯ Для полуколичественного анализа одновременно с инкубацией положительного и отрицательного контролей и образцов пациентов проводите инкубацию калибратора 2. Для количественного анализа _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru Anti-M2 ELISA (IgG), EUROIMMUN AG 3 _____________________________________________________________________________________________________ одновременно с инкубацией положительного и отрицательного контролей и образцов пациентов проводите инкубацию калибраторов 1, 2 и 3. Инкубация с образцом (1 стадия) Внесите по 100 мкл калибраторов, положительного контроля, отрицательного контроля или разведенных образцов пациентов в отдельные лунки микропланшета в соответствии с протоколом. Инкубируйте планшет при комнатной температуре (от +18 °С до + 25 °С) в течение 30 минут. Промывка Ручная: Удалите жидкость из лунок и затем промойте 3 раза, используя каждый раз по 300 мкл рабочего промывочного буфера на лунку. Автоматическая: проводите в режиме переполнения (установите программу для промывки: например, на TECAN Columbus Washer – режим “Overflow Modus”) с 3-мя циклами промывки и внесением в лунки по 400 мкл рабочего промывочного буфера. При каждом цикле промывки после заполнения лунок буфером оставляйте планшет на 30-60 секунд и затем опорожняйте. По окончании промывки (ручной или автоматической) тщательно удалите остатки жидкости из лунок, энергично постукивая перевернутым планшетом по впитывающей бумаге. Примечание: Остаточная жидкость (больше 10 мкл), обычно остающаяся в лунках после промывки, может помешать действию субстрата и снизить оптическую плотность (ОП) раствора в лунках. Недостаточно полная промывка (например, менее 3 раз, или при маленьком объеме добавляемого промывочного буфера, или при коротком времени выдерживания буфера в лунках) может в результате привести к завышенным величинам ОП в лунках. Инкубация с конъюгатом (2 стадия) Внесите в каждую лунку по 100 мкл ферментного конъюгата (меченные пероксидазой антитела к IgG человека). Инкубируйте в течение 30 минут при комнатной температуре (от +18 °С до + 25 °С). Промывка Удалите жидкость из лунок. Промойте, как описано ранее. Инкубация с субстратом (3 стадия) Внесите в каждую лунку по 100 мкл раствора хромогена/субстрата. Инкубируйте планшет в течение 15 минут при комнатной температуре (от +18 °С до +25 °С) в защищенном от прямого солнечного света месте. Остановка реакции Добавьте в каждую лунку по 100 мкл стоп-реагента (в той же последовательности и с такой же скоростью, как вносился раствор хромогена/субстрата). Измерение Фотометрическое измерение интенсивности окрашивания раствора в лунках проводят при основной длине волны 450 нм и при длине волны сравнения между 620 нм и 650 нм в течение 30 минут после добавления стоп-реагента. Перед измерением слегка покачайте планшет, чтобы добиться гомогенного распределения раствора. СХЕМА РАЗМЕЩЕНИЯ НА ПЛАНШЕТЕ ОБРАЗЦОВ И КОНТРОЛЕЙ A B C D E F G H 1 C2 pos neg P1 P2 P3 P4 P5 2 P6 P7 P8 P9 P 10 P 11 P 12 P 13 3 P 14 P 15 P 16 P 17 P 18 P 19 P 20 P 21 4 P 22 P 23 P 24 5 6 7 C1 C2 C3 pos neg P1 P2 P3 8 P4 P5 P6 P7 P8 P9 P 10 P 11 9 P 12 P 13 P 14 P 15 P 16 P 17 P 18 P 19 10 P 20 P 21 P 22 P 23 P 24 11 12 Представленная выше схема представляет собой пример размещения на планшете проб: - на стрипах 1-4 - для полуколичественного определения IgG-антител в 24 образцах пациентов (от Р 1 до Р 24); - на стрипах 7-10 - для количественного определения IgG-антител в 24 образцах пациентов (от Р 1 до Р 24). В соответствующие лунки вносят и инкубируют калибраторы (от С1 до С3), положительный контроль (pos.), отрицательный контроль (neg.), а также образцы пациентов (Р 1 – Р 24). Достоверность анализа можно увеличить, размещая и измеряя каждую анализируемую пробу в двух параллельных лунках (дубликатах). _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru Anti-M2 ELISA (IgG), EUROIMMUN AG 4 _____________________________________________________________________________________________________ Лунки можно отламывать от стрипов по одной. Это позволяет привести в соответствие используемое количество лунок и количество исследуемых образцов и, таким образом, минимизировать расход реагентов. Положительный и отрицательный контроли выполняют роль внутренних контролей для проверки правильности процедуры тестирования. Их следует использовать при каждой постановке анализа. РАСЧЕТ РЕЗУЛЬТАТОВ Полуколичественный анализ Результаты можно оценить полуколичественно, рассчитывая отношение ОП в лунке с контрольным образцом или в лунке с образцом пациента относительно ОП в лунке с калибратором 2. Для расчета этого отношения используйте следующую формулу: Отношение (RATIO) = ОП контрольного образца или образца пациента ОП калибратора 2 Фирма EUROIMMUN рекомендует следующую интерпретацию результатов: Отношение (RATIO) < 1,0: Отношение (RATIO) ≥ 1,0: Отрицательный результат Положительный результат Количественный анализ На графике линейной зависимости откладывают величины ОП, измеренные для 3 калибровочных сывороток (ось Y) против концентрации антител в этих сыворотках, выраженных в относительных единицах ОЕд/мл (ось X). По полученным точкам проводят стандартную кривую для определения концентрации антител в образцах пациентов. Для расчета кривой с помощью компьютера используйте способ построения по точкам (“point-to-point”). Ниже приведен пример типичной калибровочной кривой. Не используйте ее, пожалуйста, для определения концентрации антител в образцах пациентов. 2,0 1,8 1,6 ОП 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0,0 0 20 40 60 80 100 120 140 160 180 200 ОЕд/мл Если ОП образца пациента лежит выше величины ОП для калибратора 1 (с концентрацией 200 ОЕд/мл), результат следует выражать как “>200 ОЕд/мл”. Такой образец рекомендуется развести 1:800 и протестировать повторно, а результат, полученный по калибровочной кривой (в ОЕд/мл), умножить на коэффициент разведения 4. Верхняя граница интервала нормальных значений неинфицированных людей (уровень отсечения, cut-off), рекомендованная фирмой EUROIMMUN, составляет 20 относительных единиц (ОЕд)/мл. EUROIMMUN рекомендует следующую интерпретацию результатов: < 20 ОЕд/мл: ≥ 20 ОЕд/мл: Отрицательный результат Положительный результат Для определений, проводящихся в дубликатах, следует использовать в расчетах среднее значение двух величин. Если эти две величины существенно расходятся между собой, анализ образца следует повторить. Для установления диагноза кроме результатов серологических исследований всегда необходимо учитывать клинические симптомы пациента. _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru Anti-M2 ELISA (IgG), EUROIMMUN AG 5 _____________________________________________________________________________________________________ ХАРАКТЕРИСТИКИ ТЕСТА Калибровка: Так как в настоящее время не существует Международного стандарта (референтной сыворотки с антителами к антигенам М2), калибровка выполняется в относительных единицах (ОЕд). Для каждой группы тестов, выполненных на наборах определенной серии, величины ОП калибраторов и относительные единицы и/или отношения (RATIO), определенные для положительного и отрицательного контролей, должны лежать в границах, установленных для наборов этой серии. Протокол с установленными значениями включается в поставку набора. Если обнаружены отклонения контрольных значений от значений, указанных в спецификации, результаты теста могут быть ошибочными и тест следует повторить. Активность фермента, используемого в составе набора, зависит от температуры, поэтому, если не используется термостат, величины ОП могут различаться. Чем выше температура воздуха в помещении (от о о +18 С до +25 С) во время инкубации с субстратом, тем выше величины ОП. Сходные изменения происходят и при варьировании времени инкубации. Однако таким же воздействиям подвергаются и сыворотки калибраторов, поэтому при расчете результатов возможные колебания в основном компенсируются. Антигены: Лунки микротитровальных планшетов покрыты высоко очищенными белками пируватдегидрогеназного комплекса, выделенными из сердца свиньи. Антиген М2 – компонент трех биохимически сходных мультиферментых комплексов внутренней мембраны митохондрий. Они катализируют окислительное декарбоксилирование пирувата, α-кетоглутарата и разветвленных α-кетокислот. В соответствие с этим М2 содержит, по крайней мере, 4 различных белка: в Е2 дегидрогеназном комплексе разветвленных α-кетокислот (50 кДа), в белке Х пируватдегидрогеназного комплекса (52 кДа) и в Е2 пируватдегидрогеназном комплексе (74 кДа). Ферменты Е2 катализируют перенос ацильной группы на коэнзим А, белок Х является субъединицей пируватдегидрогеназного комплекса, функция его не известна. Линейность: Линейность теста исследовали, используя серию разведений сыворотки пациента с высокой концентрацией антител. Тест Anti-М2 ELISA (IgG) линеен в пределах интервала измерения 2 – 200 ОЕд/мл. Граница определения: Граница определения – это величина, равная 3SD образца, не содержащего аналита, и представляет собой наименьший определяемый титр антител. Граница определения теста AntiМ2 ELISA (IgG) составляет приблизительно 1 ОЕд/мл. Перекрестная реактивность: Этот ИФА тест не обладает перекрестной реактивностью. Вещества, мешающие определению: На результаты анализа не влияли признаки гемолиза, повышенное содержание липидов и признаки желтухи в образцах с концентрациями гемоглобина вплоть до 10 мг/мл, триглицеридов – до 20 мг/мл и билирубина – до 0,4 мг/мл. Воспроизводимость: Воспроизводимость теста исследовали, определяя коэффициент вариации (CV) результатов анализа трех сывороток с концентрациями антител, попадающими на разные участки калибровочной кривой. Величины CV внутри одного опыта определяли из 20 параллельных измерений каждой сыворотки. Величины CV в разных опытах получали, проводя по 4 параллельных измерения каждой сыворотки в течение 6 различных дней. Вариабельность внутри одного опыта, n = 20 Сыворотка Среднее CV (ОЕд/мл) (%) 1 77 4,1 2 122 3,9 3 150 4,1 Вариабельность в разных опытах, n = 4 × 6 Сыворотка Среднее CV (ОЕд/мл) (%) 1 73 3,2 2 121 3,3 3 146 2,9 Специфичность и чувствительность: С помощью ИФА теста EUROIMMUN обследовали группу из 206 здоровых доноров крови. Тест показал 100%-ную специфичность. С помощью ИФА теста EUROIMMUN обследовали группу из 26 пациентов с первичным билиарным циррозом (PBC). Тест показал 100%-ную чувствительность. Референтный интервал: Уровни IgG-антител к М2 анализировали, используя этот ИФА набор EUROIMMUN, в группе 206 здоровых доноров крови. При уровне отсечения (cut-off), равном 20 ОЕд/мл, все доноры крови оказались отрицательными по антителам к М2. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ АНТИТЕЛ К МИТОХОНДРИЯМ Митохондрии содержат множество биохимически определяемых антигенов, которые важны при аутоиммунных заболеваниях. Соответственно, в настоящее время различают девять типов АМА (М1 - М9). _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru Anti-M2 ELISA (IgG), EUROIMMUN AG 6 _____________________________________________________________________________________________________ Антитела к митохондриям (АМА) можно обнаружить на различных стадиях заболевания (см. таблицу). Эти антитела часто обнаруживаются совместно с другими антителами, например, с ANA. Антитела против Статус заболевания Распространение М1 сифилис (указание активности) острая красная волчанка прогрессирующий системный склероз, синдром Шегрена, синдром Шарпа, ревматоидный артрит тромбозы, привычный выкидыш 100% 50% 5-15% часто М2 первичный билиарный цирроз печени (высокий титр) другие хронические заболевания печени прогрессирующий системный склероз до 96% 30% 7-25% М3 синдром псевдоволчанки (например, волчанки, индуцированной пиразолоном) 100% М4 первичный билиарный цирроз печени М5 неспецифические коллагенозы редко М6 гепатит (индуцированный иприоназидом) 100% М7 острый миокардит кардиомиопатии 60% 30% М8 первичный билиарный цирроз печени до 55% М9 первичный билиарный цирроз печени -М2-негативные пациенты (первичная стадия) -М2-позитивные пациенты хронический активный аутоиммунный гепатит острый и хронический гепатит 82% 37-44% 10% 3% до 55% Определение антител к митохондриям имеет существенно важное значение для диагностики первичного гипертрофированного билиарного цирроза печени (PBC). До настоящего времени в сыворотке больных РВС определяли 4 различных типа АМА: антитела к антигенам М2, М4, М8 и М9. Антитела к антигену М2 являются специфичным и чувствительным маркером первичного билиарного цирроза печени, они могут быть обнаружены у 96% всех пациентов. Распространенность антител к антигенам М4, М8 и М9 значительно меньше, антитела к М4 и М8 всегда ассоциированы с антителами к М2. Также до сих пор следует оценивать диагностическую значимость антител к М4 и М9. Результаты, полученные до недавнего времени, указывают на то, что антитела к М4 являются признаком неблагоприятного прогрессирования заболевания. Антитела к М9 обнаруживаются, в основном, у больных с первичным билиарным циррозом на ранних стадиях (82%), когда антитела к М2 в некоторых случаях еще не продуцируются. В таких случаях антитела к М9 относятся к IgM-классу (более, чем на 90%). Если антитела к М2 уже детектируются, распространенность М9 антител составляет только 37%, из которых 50% принадлежит исключительно IgM-классу. Присутствие М9-антител является указанием на неблагоприятное развитие заболевания. Высокий титр антител к М2 - характерная черта первичного билиарного цирроза, при этом Е2 фермент и белок Х пируватдегидрогеназного комплекса являются основными антигенами. Более того, антитела к М2 также можно обнаружить – в основном с низким титром – при других хронических заболеваниях печени (30%) и при прогрессирующем системном склерозе (7-25%). У пациентов с прогрессирующим системным склерозом, для которого продемонстрировано наличие антител к М2, возможно клиническое перекрывание с первичным билиарным циррозом. Первичный билиарный цирроз печени – хроническое воспалительное заболевание печени с неясной этиологией, которое относят к аутоиммунным заболеваниям. Болезнь характеризуется лимфоцеллюлярным инфильтратом вокруг внутрипеченочных желчных протоков, а также высокой специфичностью и широкой распространенностью антител к митохондриям. Клиническое проявление заболевания начинается с часто неспецифических, очень сильно различающихся между собой основных симптомов, таких как зуд _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru Anti-M2 ELISA (IgG), EUROIMMUN AG 7 _____________________________________________________________________________________________________ (микропапулезная экзантема), слабость и боли в правой верхней части живота. Обструкционная желтуха развивается после различающегося по продолжительности промежутка времени. Специфическим индикатором является повышение уровня липидов в сыворотке крови. Гистологически в печени обнаруживаются изменения, соответствующие хроническому негнойному деструктивному холангиту с гранулированным перихолангитом, медленно прогрессирующее разрушение небольших и средних желчных протоков с последующим фиброзом, заключительной стадией которого является полный цирроз. Кроме печени, часто и другие органы с внешней секрецией вовлечены в развитие болезни, к таким органам относятся слезные железы, слюнные железы, поджелудочная железа и особенно часто щитовидная железа. Распространенность первичного билиарного цирроза печени, оцененная на группе английских пациентов, составляет 140 случаев на 1 миллион жителей. В Европе первичный билиарный цирроз печени является наиболее частым показанием для пересадки печени. Возраст, при котором проявляется заболевание, составляет от 20 до 70 лет, причем женщины подвержены заболеванию в шесть-десять раз чаще, чем мужчины. До сих пор заболевание не было обнаружено у детей. Примечание: В случае отрицательных результатов определения АМА и М2, но при постоянных указаниях на первичный билиарный цирроз печени, рекомендуется дополнительное тестирование на антитела к ядерным гранулам (ядерные точки, SP100), так как это исследование также имеет патогномоничное значение для диагностики заболевания. Наиболее надежный метод тестирования этих антител – непрямой иммунофлуоресцентный метод с использованием комбинации субстратов Hep-2 клеток/печени приматов (FA1510). СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ Список литературы приведен в оригинале инструкции на английском языке. Внимание! Перевод сделан с английского оригинала инструкции. Перед постановкой исследования сверьте номер и дату издания вложенного в набор оригинала с указанными в настоящем переводе (см. внизу справа). При несовпадении номеров или дат обратитесь в «Аналитику» за новым переводом, либо руководствуйтесь оригиналом инструкции. AMA M2_IgG_EA_1622-9601G.doc 08.08.05 10:55 Оригинал EA_1622G_A_UK_C01.doc – 10.09.03 11:00 _____________________________________________________________________________________________________ Перевод на русский язык ЗАО «АНАЛИТИКА», Москва, 2005 тел.: 737-0363, факс: 737-0365, e-mail: info@analytica.ru