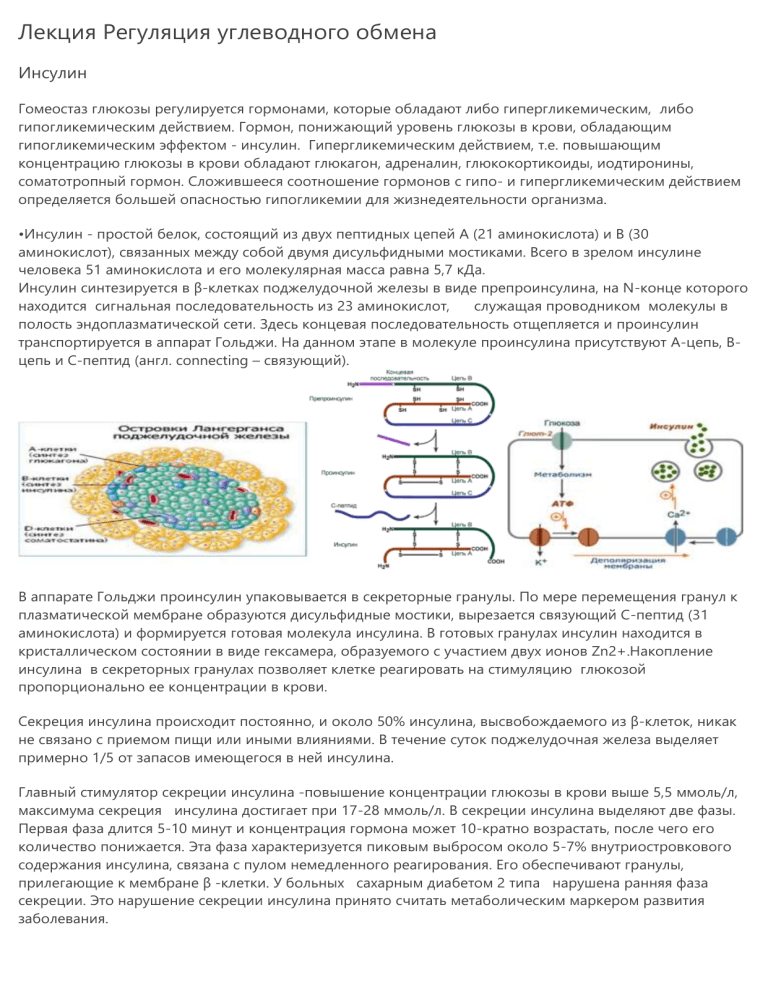
Лекция Регуляция углеводного обмена Инсулин Гомеостаз глюкозы регулируется гормонами, которые обладают либо гипергликемическим, либо гипогликемическим действием. Гормон, понижающий уровень глюкозы в крови, обладающим гипогликемическим эффектом - инсулин. Гипергликемическим действием, т.е. повышающим концентрацию глюкозы в крови обладают глюкагон, адреналин, глюкокортикоиды, иодтиронины, соматотропный гормон. Сложившееся соотношение гормонов с гипо- и гипергликемическим действием определяется большей опасностью гипогликемии для жизнедеятельности организма. •Инсулин - простой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой двумя дисульфидными мостиками. Всего в зрелом инсулине человека 51 аминокислота и его молекулярная масса равна 5,7 кДа. Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится сигнальная последовательность из 23 аминокислот, служащая проводником молекулы в полость эндоплазматической сети. Здесь концевая последовательность отщепляется и проинсулин транспортируется в аппарат Гольджи. На данном этапе в молекуле проинсулина присутствуют А-цепь, Вцепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы. По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn2+.Накопление инсулина в секреторных гранулах позволяет клетке реагировать на стимуляцию глюкозой пропорционально ее концентрации в крови. Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина. Главный стимулятор секреции инсулина -повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция инсулина достигает при 17-28 ммоль/л. В секреции инсулина выделяют две фазы. Первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается. Эта фаза характеризуется пиковым выбросом около 5-7% внутриостровкового содержания инсулина, связана с пулом немедленного реагирования. Его обеспечивают гранулы, прилегающие к мембране β -клетки. У больных сахарным диабетом 2 типа нарушена ранняя фаза секреции. Это нарушение секреции инсулина принято считать метаболическим маркером развития заболевания. Вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз. Во вторую фазу секреция инсулина происходит постепенно, составляет 93-95% запасов инсулина. Поступившая в бета-клетку глюкоза подвергается окислению с образованием АТФ, накопление которого закрывает калиевые каналы и деполяризует мембраны. Деполяризация мембраны вызывает открытие кальциевых каналов, повышению концентрации кальция в клетке. Дополнительно этому способствует активация образования инозитолтрифосфата, который также активирует кальциевые АТФазы на цистернах эндоплазматического ретикулума. Кальций стимулирует передвижение секреторных гранул к мембране, слиянию и экзоцитозу гранул. Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенцируют действие глюкозы. Секреция инсулина активируется под действием гормонов желудочно-кишечного тракта холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида. Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции. Из β-клеток инсулин поступает в кровь. В крови он содержится в двух формах, т.е. может быть свободным и связанным с белками. Свободный действует на все чувствительные к инсулину ткани (печень, мышцы, жировую и соединительную ткани), а связанный – только на жировую ткань, способную освобождать инсулин из связи с белком. В меньшей степени чувствительна к инсулину ткань печени, и совсем нечувствительна нервная ткань (чувствительность к инсулину определяется числом специфических мембранных рецепторов). Между содержанием свободного и связанного инсулина существует динамическое равновесие: при повышенной потребности организма в инсулине (например, после сладкой пищи) увеличивается количество свободной фракции и уменьшается содержание связанного инсулина, а натощак преобладает связанный инсулин. Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер. Наибольшая концентрация рецепторов наблюдается на мембране гепатоцитов (100-200 тыс на клетку) и адипоцитов (около 50 тыс на клетку), клетка скелетной мышцы имеет около 10 тысяч рецепторов, а эритроциты - только 40 рецепторов на клетку. После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки - субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAPкиназный путь и ФИ-3-киназный механизмы действия. При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности "метаболических" ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетилSКоА-карбоксилазы и других. При реализации MAP-киназного механизма (англ - mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза. Биологические эффекты инсулина подразделяются по скорости развития: Очень быстрые эффекты (секунды) Эти эффекты связаны с изменением трансмембранных транспортеров Активации Na+/K+-АТФазы, Na+/H+-обменника Ca2+-АТФазы Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку. Быстрые эффекты (минуты). Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков. Печень торможение эффектов адреналина и глюкагона (фосфодиэстераза), ускорение гликогеногенеза (гликогенсинтаза), активация гликолиза (фосфофруктокиназа, пируваткиназа), превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа), усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза), формирование ЛПОНП, повышение синтеза холестерина (ГМГ-SКоА-редуктаза Мышцы торможение эффектов адреналина (фосфодиэстераза), стимулирует транспорт глюкозы в клетки (активация ГлюТ-4), стимуляция гликогеногенеза (гликогенсинтаза), активация гликолиза (фосфофруктокиназа, пируваткиназа), превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа), усиливает транспорт нейтральных аминокислот в мышцы, стимулирует трансляцию (рибосомальный синтез белков). Жировая ткань •стимулирует транспорт глюкозы в клетки (активация Глют-4), •активирует запасание жирных кислот в тканях (липопротеинлипаза), •активация гликолиза (фосфофруктокиназа, пируваткиназа), •усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы), •создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы). Медленные эффекты (минуты-часы) Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например: 1. Индукция синтеза ферментов в печени глюкокиназы и пируваткиназы (гликолиз), АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы (синтез жирных кислот), глюкозо-6-фосфатдегидрогеназы (пентозофосфатный путь). 2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот. 3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы (глюконеогенез). 4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6. Вместе с инсулином в кровь поступают проинсулин и С-пептид. Проинсулин реагирует со всеми инсулинчувствительными тканями, но биологическая активность его значительно меньше, чем у инсулина. В норме содержание проинсулина в периферической крови составляет не более 20% от общего инсулина, а в патологических условиях количество проинсулина и С-пептида может значительно возрастать. Соответственно, снижается биологический эффект инсулина. Инсулин и С-пептид секретируются в кровь в эквимолярных количествах. Поскольку лечебные препараты инсулина не содержат С-пептид, определение его в сыворотке крови позволяет оценить функцию β-клеток поджелудочной железы у больных сахарным диабетом, получающих инсулин. ГЛЮТы Потребление клетками глюкозы из кровотока происходит путем облегченной диффузии при участии специальных белков-транспортеров (ГЛЮТов). Следовательно, скорость трансмембранного потока глюкозы зависит только от градиента ее концентрации. Исключением являются клетки мышц и жировой ткани, где облегченная диффузия регулируется инсулином. В отсутствие инсулина плазматическая мембрана этих клеток непроницаема для глюкозы, так как в ней нет белков-переносчиков для глюкозы (ГЛЮТов). ГЛЮТы обнаружены во всех тканях. Существует несколько разновидностей ГЛЮТов, которые пронумерованы по порядку их обнаружения. Все пять типов ГЛЮТов имеют сходную первичную структуру. ГЛЮТ-1 служит для обеспечения стабильного потока глюкозы в мозг. В других тканях (плаценте, почках, толстой кишке) он поставляет глюкозу в клетки, когда они находятся в состоянии покоя. ГЛЮТ-2 обнаружен в клетках органов, выделяющих глюкозу в кровь (печень, b-клетки островков Лангерганса). При участии ГЛЮТ-2 глюкоза переходит в кровь из энтероцита после ее всасывания в кишечник. ГЛЮТ-3 обладает большим, чем ГЛЮТ-1, сродством к глюкозе. Он также обеспечивает постоянный приток глюкозы к клеткам нервной системы, плаценте, почкам. ГЛЮТ-4 – главный переносчик глюкозы в мышцах и адипоцитах. ГЛЮТ-5 встречается главным образом в клетках тонкой кишки. Возможно, является переносчиком фруктозы. Все типы ГЛЮТов могут находиться как в плазматической мембране, так и в цитозольных везикулах. В отсутствие инсулина ГЛЮТ-4 (и, в меньшей степени, ГЛЮТ-1) почти полностью находится в цитоплазме. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТы, к плазматической мембране и их слиянию с ней, после чего возможен активный транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови белки-транспортеры глюкозы снова перемещаются в цитозоль. В клетки печени глюкоза поступает при участии ГЛЮТа-2, который сохраняет свою локализацию в мембране независимо от инсулина. Гормоны, которые повышают содержание глюкозы в крови, называются контринсулярными. Это адреналин, глюкагон, глюкокортикоиды, соматотропин и др. Адреналин Влияние адреналина на углеводный обмен реализуется через α- и β-рецепторы (БР). Влияние адреналина на углеводный обмен через β-белки-рецепторы. Адреналин обладает мембранно-внутриклеточным механизмом действия. Он связывается с β-белками-рецепторами, которые находятся на внешней стороне цитоплазматической мембраны. Образование комплекса адреналин – белок-рецептор приводит к активации аденилатциклазы, которая находится на внутренней стороне мембраны. Под действием аденилатциклазы происходит образование циклической АМФ (цАМФ) из АТФ. цАМФ по аллостерическому типу активирует протеинкиназу. Последняя активирует киназу фосфорилазы путем фосфорилирования, а та, в свою очередь, активирует гликогенфосфорилазу также путем фосфорилирования. Гликогенфосфорилаза катализирует фосфоролитическую атаку гликозидных связей в молекуле гликогена, в результате которой происходит отщепление глюкозного остатка в виде глюкозо-1-фосфата. Глюкозо-1-фосфат подвергается изомеризации с образованием глюкозо-6-фосфата, который в печени под действием глюкозо-6фосфатазы превращается в свободную глюкозу, поступающую в кровь. Другим вариантом использования глюкозо-6-фосфата является распад ради энергии. При распаде гликогена в мышечных клетках при гидролизе α1-6 гликозидных связей образуется небольшое количество (около 10%) свободной глюкозы. Однако, из-за отсутствия в мембранах соответствующего ГЛЮТа она не может покинуть клетку. Влияние адреналина на углеводный обмен в ядре реализуется также через внутриклеточный посредник гормонального действия, т.е. через цАМФ, который проникает в ядро из цитоплазмы. цАМФ активирует ядерную протеинкиназу, которая активирует ядерный белок путем фосфорилирования, регулирующий экспрессию генов, кодирующих ключевые ферменты глюконеогенеза (пируваткарбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-дифосфатаза и глюкозо-6-фосфатаза), т.е. усиливает таким образом активность глюконеогенеза. Влияние адреналина на углеводный обмен через α-белки-рецепторы. Взаимодействие адреналина с α-рецепторами приводит к активации мембранной фосфолипазы С (ФЛС), которая катализирует образование инозитолтрифосфата (ИТФ) и диацилглицерола (ДГ) из фосфоинозитолдифосфата (ФИДФ) (рис. 2). ИТФ способствует высвобождению ионов Са2+ из митохондрий и цистерн эндоплазматического ретикулума (ЭПР). Кальций далее активирует кальмодулин и протеинкиназу С. Кальмодулин, в свою очередь, активирует киназу фосфорилазы (КФ), а она ингибирует гликогенсинтазу и активирует гликогенфосфорилазу. Другой продукт гидролиза ФИДФ – диацилглицерол активирует мембранную протеинкиназу С (ПКС), которая путем фосфорилирования ингибирует гликогенсинтазу. Таким образом, адреналин повышает содержание глюкозы в крови за счет стимуляции фосфоролиза гликогена печени, а в более поздние сроки и активации глюконеогенеза. Повышенная секреция адреналина происходит при понижении содержания глюкозы в крови, а также при состоянии симпатического напряжения организма. Глюкагон обладает мембранно-внутриклеточным механизмом действия и подобно адреналину, действующему через β-белки-рецепторы, стимулирует мобилизацию гликогена в клетках печени. Глюкокортикоиды – стероидные гормоны, вырабатываемые в коре надпочечников. Они обладают цитозольным механизмом действия. Будучи стероидами, проходят цитоплазматическую мембрану клеток-мишеней (печень), в цитозоле соединяются с цитоплазматическим рецептором, в виде такого комплекса проходят в ядро, где регулируют экспрессию генов и способствуют синтезу ключевых ферментов глюконеогенеза. Глюкокортикоиды повышают содержание глюкозы в крови за счет стимуляции глюконеогенеза. Гиперпродукция глюкокортикоидов приводит к гипергликемии, глюкозурии – синдром Иценко – Кушинга («стероидный Глюкозурия – это выделение глюкозы в моче. В норме глюкоза в моче отсутствует. Причиной глюкозурии может быть гипергликемия или нарушение реабсорбции глюкозы в почечных канальцах. Когда содержание глюкозы в крови достигает относительно высокого уровня, в процесс регуляции ее гомеостаза включаются и почки. Глюкоза фильтруется почечными клубочками и обычно полностью возвращается в кровь в результате реабсорбции (обратного всасывания) в почечных канальцах. Процесс реабсорбции глюкозы связан с расходованием АТФ в клетках почечных канальцев. Максимальная скорость реабсорбции глюкозы в почечных канальцах около 350 мг ∙ мин –1. При повышенном содержании глюкозы в крови клубочковый фильтрат содержит больше глюкозы, чем может быть реабсорбировано в канальцах. Избыток глюкозы выводится с мочой, т.е. возникает глюкозурия. У здоровых людей глюкозурия наблюдается в том случае, если содержание глюкозы в венозной крови превышает 9,3–9,9 ммоль/л; этот уровень называют почечным порогом для глюкозы. Глюкозурия часто является указанием на заболевание сахарным диабетом. У подопытных животных можно вызвать глюкозурию с помощью флоридзина, ингибирующего реабсорбцию глюкозы в почечных канальцах. Такую глюкозурию, обусловленную нарушением реабсорбции глюкозы, называют почечной глюкозурией. Причиной почечной глюкозурии может быть наследственный дефект почек, или же она может развиться в результате ряда заболеваний. В данном случае глюкозурия сочетается с нормальной или даже пониженной концентрацией глюкозы в крови. Нарушения при сахарном диабете Сахарный диабет – одна из самых распространенных болезней: в мире насчитывается около 30 млн. больных диабетом. В основе болезни лежит нарушение регуляции обмена углеводов инсулином. При некоторых формах диабета синтез инсулина снижен и его концентрация в крови в несколько раз меньше, чем в норме. Такие формы поддаются лечению инсулином: это так называемый инсулинозависимый диабет, или диабет I типа. Есть формы, когда содержание инсулина в крови нормально, – инсулинонезависимый диабет, или диабет II типа; очевидно, в этих случаях имеются нарушения не синтеза инсулина, а других звеньев инсулиновой регуляции, например взаимодействия с рецепторами. Все формы проявляются как недостаточность инсулина. Рассмотрим биохимические механизмы развития основных признаков нарушения углеводного обмена при сахарном диабете. 1. Гипергликемия развивается как результат следующих нарушений: нарушение проницаемости плазматических мембран инсулинозависимых клеток для глюкозы; усиление контринсулярными гормонами мобилизации гликогена, опустошение гликогеновых депо; усиление контринсулярными гормонами образования глюкозы по пути глюконеогенеза. 2. Глюкозурия. Когда концентрация глюкозы в крови превышает почечный порог, глюкоза начинает выделяться с мочой. При сахарном диабете за сутки с мочой может выводиться больше 100 г глюкозы. Именно глюкозурия послужила основанием для названия болезни – diabetes mellitus (от лат. diabetes – прохожу через, melle – мед). Название возникло в те времена, когда врачи, анализируя мочу, пробовали ее на вкус. 3. Образование глюкозилированного гемоглобина. Белки при инкубации в растворе глюкозы могут неферментативно глюкозилироваться: остатки глюкозы присоединяются к свободным аминогруппам белков. Эта реакция происходит и в организме. При нормальной концентрации глюкозы ее скорость невелика, а, поскольку белки постоянно обновляются, глюкозилированные белки не накапливаются. При диабете вследствие гипергликемии скорость глюкозилирования увеличивается. Например, у здоровых людей глюкозилировано более 5% всего гемоглобина, а у больных диабетом – в 2–3 раза больше. Глюкозилирование изменяет свойства белков и нарушает их функции. 4. Образование сорбитола. В некоторых клетках при сахарном диабете из глюкозы образуется шестиатомный спирт сорбитол. Сорбитол плохо проникает через клеточные мембраны, его накопление приводит к осмотическому набуханию клеток и нарушению их функций . Лактацидоз - смещение рН крови в кислую сторону, вызванное накоплением лактата Повышение содержания лактата в крови является следствием нарушения соотношения процессов образования и утилизации лактата. При тканевой гипоксии во внепеченочных клетках снижается скорость окислительного декарбоксилирования пирувата. В этих условиях происходит увеличение количества восстановленных НАД вследствие чего равновесие реакции пируват → лактат смещается в сторону образования лактата. Кроме того, главным путем утилизации, образовавшегося во внепеченочных тканях лактата (например в эритроцитах) является глюконеогенез. Для вступления на этот путь лактат должен окислиться до пирувата. Протекание этой реакции возможно при условии, что лактатдегидрогеназа содержит в качестве кофермента окисленную форму НАД. Поэтому все причины, вызывающие увеличение количества восстановленных форм НАД будут тормозить вступление лактата на путь глюконеогенеза и способствовать накоплению его в крови. Возникновению лактатацидоза также способствует нарушение глюконеогенеза при печеночной недостаточности. Итак, причинами накопления лактата и развития лактатацидоза могут быть: нарушение доставки или утилизации кислорода тканями (сердечная или дыхательная недостаточность , шок, тяжелая анемия , дефекты митохондриальных ферментов или ингибирование ферментов митохондриальных электронтранспортных цепей (ротенон , аминазин, окись углерода и т.д.) избыточное образование лактата или недостаточная утилизация лактата (эпилептические припадки, сахарный диабет, алкогольная интоксикация, печеночная недостаточность, злокачественные новообразования, отравление салицилатами), повреждения печени (токсические дистрофии, цирроз и др.), гиповитаминоз В1; нарушение использования лактата вследствие наследственных дефектов ферментов глюконеогенеза, недостаточности глюкозо-6-фосфатазы; применение ряда лекарственных препаратов, например бигуанидов (блокаторов глюконеогенеза, используемых при лечении сахарного диабета).









