Количество веществаx
реклама
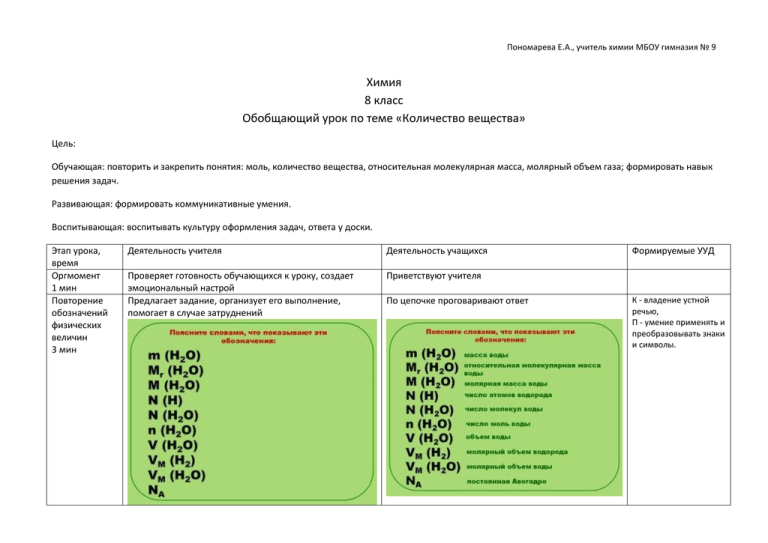
Пономарева Е.А., учитель химии МБОУ гимназия № 9 Химия 8 класс Обобщающий урок по теме «Количество вещества» Цель: Обучающая: повторить и закрепить понятия: моль, количество вещества, относительная молекулярная масса, молярный объем газа; формировать навык решения задач. Развивающая: формировать коммуникативные умения. Воспитывающая: воспитывать культуру оформления задач, ответа у доски. Этап урока, время Оргмомент 1 мин Повторение обозначений физических величин 3 мин Деятельность учителя Деятельность учащихся Проверяет готовность обучающихся к уроку, создает эмоциональный настрой Предлагает задание, организует его выполнение, помогает в случае затруднений Приветствуют учителя По цепочке проговаривают ответ Формируемые УУД К - владение устной речью, П - умение применять и преобразовывать знаки и символы. Пономарева Е.А., учитель химии МБОУ гимназия № 9 Проверка понимания физических величин 7 мин Приведите примеры возможных значений данных величин. Подчеркните те, которые являются постоянными для данного вещества. Задание выполняется на интерактивной доске, остальные учащиеся работают в тетрадях. (Предполагаемый ответ обучающихся. Постоянными величинами являются: Mr(H2O) = 18, M(H2O) = 18 г/моль, VM (H2) = 22,4 л/моль, VM(Н2О) = 18 мл/моль, NA = 6*1023 моль-1. Количество атомов или молекул может быть только целыми числами. Остальные значения могут быть любыми. Например, m(H2O)= 5,5 кг, N (H) = 500, N(H2O) = 1000000, n(H2O) = 0,01 моль, V(H2O) = 1/3 мл) П - умение применять и преобразовывать знаки и символы. Работа со схемой 4 мин Организует выполнение задания в парах и его проверку Работая в парах, дополняют в тетради схему, потом один из учащихся озвучивают результат, остальные сверяют П – умение определять понятия; К - умение организовывать учебное сотрудничество и совместную деятельность со сверстниками Пономарева Е.А., учитель химии МБОУ гимназия № 9 Задание на понимание понятия "моль" 5 мин Организует работу в группах, проверку и комментирование задания Обсуждают в группах, потом кто-то из учеников озвучивает и аргументирует свою точку зрения К - работать в группе: находить общее решение; формулировать, аргументировать и отстаивать своё мнение; П - строить логическое рассуждение, умозаключение Решение типовых задач 20 минут Организует решение и оформление задачи 1 у доски, самостоятельную работу с заданиями 2-4, их проверку у доски. Первая строчка заполняется коллективно, 1 из учащихся работает у доски, остальные – в тетрадях. Следующие 3 задачи решаются в ходе самостоятельной работы по рядам с последующей проверкой и обсуждением. В результате у каждого ученика в тетради должны оказаться решенными все четыре задачи. Обратить внимание учеников, почему нет вопроса об объемах серной кислоты и оксида алюминия? Дано: Решение. n(CO2) = 0,5 моль М(CO2)= 44 г/моль m(CO2)= 0,5*44 = 22 г М(CO2)-? N(CO2)= 0,5*6*1023= 3*1023 m(CO2)-? N(C+O)= 3*1023*3 = 9*1023 N(CO2)-? V(CO2)= 0,5*22,4 = 11,2 л N(C+O)-? V(CO2)-? П - умение создавать, применять и преобразовывать знаки и символы для решения учебных задач; К - владение монологической контекстной речью; Р - осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий и требований Пономарева Е.А., учитель химии МБОУ гимназия № 9 Рефлексия 1 мин Подведение итогов урока 2 мин Домашнее задание 2 мин Предлагает оценить каждому ученику свое владение материалом темы Подводит итоги, выставляет оценки активным учащимся Ставят оценку в своей тетради Озвучивает задание, дает комментарий к домашнему заданию. Повторить параграфы 9-11 (химическая связь) Задача. Масса одного атома водорода составляет 1,7*10-24 граммов. Как это можно было вычислить? Записывают домашнее задание Р - владение основами самооценки











