Программа по химии Строение атома 1.
реклама

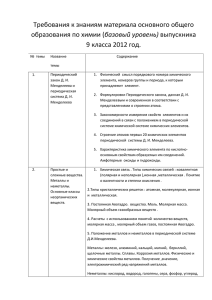
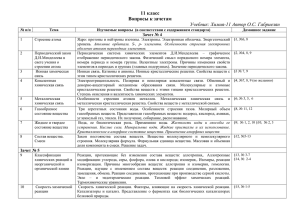
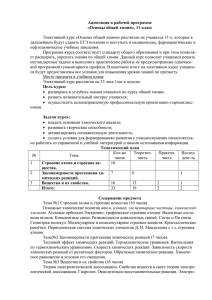
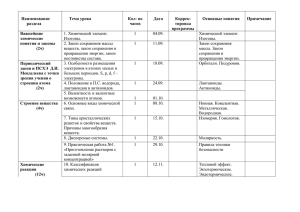
Программа вступительных испытаний по химии Программа по химии 1. Строение атома Атом — сложная частица. Ядро и электронная оболочка. Электроны, протоны и нейтроны. Состояние электронов в атоме. Электронное облако и орбиталь. Форма орбиталей (s, p, d, f). Энергетические уровни и подуровни. Принцип Паули и правило Гунда. Электронная классификация элементов: Валентные электроны. Валентные возможности атомов химических элементов. Сравнение понятий «валентность» и «степень окисления». 2. Периодический закон и строение атома Изотопы. Современная трактовка понятия «химический элемент». Периодическая система Д. И. Менделеева и строение атома. Физический смысл порядкового номера элементов, номеров группы и периода. 3. Строение вещества Химическая связь. Ионная химическая связь и ионные кристаллические решетки. Ковалентная химическая связь и ее классификация. Полярность связи и полярность молекулы. Металлическая химическая связь и металлические кристаллические решетки. Водородная связь: межмолекулярная и внутримолекулярная. Свойства ковалентной химической связи. Насыщаемость, направленность. Геометрия молекул. 4. Химические реакции Классификация химических реакций, понятие о химической реакции. Реакции, идущие без изменения качественного состава веществ: изомеризация и полимеризация. Реакции, идущие с изменением состава веществ: по числу и составу реагирующих и образующихся веществ (разложения, соединения, замещения, обмена); по изменению степеней окисления элементов (окислительно-восстановительные реакции и не окислительно-восстановительные реакции); по тепловому эффекту (экзо - и эндотермические); по направлению (обратимые и необратимые). 5. Энергетика и кинетика химических реакций Закон сохранения энергии. Внутренняя энергия. Тепловой эффект химических реакций. Термохимические уравнения. Скорость химических реакций. Факторы, влияющие на скорость химической реакции. Обратимость химических реакций. Понятие о химическом равновесии. Динамичность химического равновесия. Константа равновесия. Факторы, влияющие на смещение равновесия: концентрация, давление и температура. Принцип Ле Шателье. 6. Растворы Электролитическая диссоциация. Электролиты и не электролиты. Катионы и Программа вступительных испытаний по химии анионы. Кислоты, соли, основания в свете электролитической диссоциации. Степень электролитической диссоциации. Константа диссоциации. Реакции, протекающие в растворах электролитов. Водородный показатель. Диссоциация воды. Ионное произведение воды. Водородный показатель рН. Понятие «гидролиз». Гидролиз солей. 7. Вещества и их свойства Классификация неорганических веществ. Простые и сложные вещества. Оксиды, их классификация. Гидроксиды (основания, кислородсодержащие кислоты, амфотерные гидроксиды). Кислоты, их классификация. Основания, их классификация. Соли средние, кислые, основные и комплексные. Металлы. Положение металлов в периодической системе Д. И. Менделеева и строение их атомов. Аллотропия. Ряд стандартных электродных потенциалов. Общие химические свойства металлов. Общие способы получения металлов. Металлы в природе. Электролиз расплавов и растворов соединений металлов и его практическое значение. Переходные металлы:. железо, медь, серебро, цинк, ртуть (нахождение в природе; получение и применение простых веществ; свойства простых веществ; важнейшие соединения). Неметаллы. Положение неметаллов в периодической системе Д. И. Менделеева, строение их атомов. Электроотрицательность. Инертные газы. Неметаллы — простые вещества. Аллотропия и ее причины. Химические свойства неметаллов. Восстановительные свойства неметаллов в реакциях с фтором, кислородом, сложными веществами-окислителями (азотной и серной кислотами и др.). Водородные соединения неметаллов. Получение, физические свойства. Отношение к воде. Кислородные кислоты. Изменение кислотных свойств высших оксидов и гидроксидов неметаллов в периодах и группах.. Классификация оснований. Химические свойства щелочей и нерастворимых оснований. Свойства безкислородных оснований: аммиака и аминов. Амфотерные соединения. Амфотерность оксидов и гидроксидов некоторых металлов: взаимодействие с кислотами и щелочами.. 8. Основы органической химии Классификация органических веществ. Углеводороды и классификация веществ в зависимости от строения углеродной цепи и от кратности связей. Гомологический ряд. Производные углеводородов: галогеналканы, спирты, фенолы, альдегиды и кетоны, карбоновые кислоты, простые и сложные эфиры, нитросоединения, амины, аминокислоты, белки. 9. Химия и общество Сырье для химической промышленности. Вода в химической промышленности. Защита окружающей среды и охрана труда при Программа вступительных испытаний по химии химическом производстве. Химия и экология. Химическое загрязнение окружающей среды. Охрана гидросферы от химического загрязнения. Химия и пища.