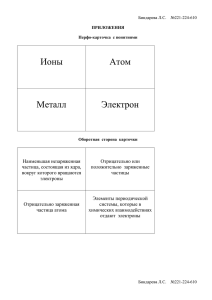
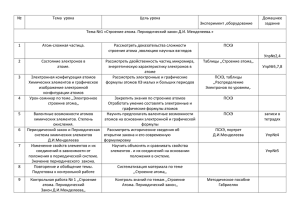
Рабочая программа по ХИМИИ, 11 класс Пояснительная записка
реклама

Рабочая программа по ХИМИИ, 11 класс Пояснительная записка Рабочая программа курса химии 11 класса (базовый уровень) составлена в соответствии: с законом «Об образовании», с.32, «Компетенции и ответственность образовательного учреждения; с федеральным компонентом государственного стандарта основного общего образования, утвержденного Министерством образования Российской Федерации «Об утверждении федерального компонента государственных стандартов начального общего, основного общего и среднего(полного) общего образования» от 05.03.2004 N 1089; с программой курса химии для 8-11 классов ОУ; автор О.С.Габриелян (2011г); с федеральным перечнем учебников, рекомендованных (допущенных) Министерством образования Российской Федерации к использованию в образовательном процессе в ОУ на 2014 – 2015 уч.г. (приказ Министерства образования и науки Российской Федерации №2885 от 27.12.2011); с учебным планом МБОУ СОШ № 71. Цели и задачи курса: Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций: умение самостоятельно и мотивированно организовывать свою познавательную деятельность; использование элементов причинно – следственного и структурно – функционального анализа; определение сущностных характеристик изучаемого объекта; умение развернуто обосновывать суждения, давать определения, приводить доказательства; оценивание и корректировка своего поведения в окружающем мире. Требования к уровню подготовки обучающихся включают в себя как требования, основанные на усвоении и воспроизведении учебного материала, понимании смысла химических понятий и явлений, так и основанные на более сложных видах деятельности: объяснении физических и химических явлений, приведение примеров практического использования изучаемых химических явлений и законов. Требования направлены на реализацию деятельностного, практико – ориентированного и личностно ориентированного подходов, овладение учащимися способами интеллектуальной и практической деятельности, овладение знаниями и умениями, востребованными в повседневной жизни, позволяющими ориентироваться в окружающем мире, значимыми для сохранения окружающей среды и собственного здоровья. Учебно – методический комплект: Габриелян О.С. Химия11 класс. Учебник базовый уровень. М. Дрофа, 2009 г. Новошинский И.И. Типы химических задач и способы их решений 8-11 кл. М.: Оникс,2007. Рябов М.А.Тесты по химии к учебнику О.С.Габриеляна 11кл.М. «Экзамен», 2010. Контрольные и проверочные работы 11кл.М., Дрофа, 2013 Ю.Н.Казанцев Конструктор текущего контроля 11кл. М., «Просвещение»,2009. Количество учебных часов – 35 (1 час в неделю) Контрольных работ - 3 Практических работ - 1 Резервное время -1 ч Объединены темы: № 1. «Строение атома» и № 2. «Строение вещества» в тему «Строение атома и вещества», сокращено время с 17ч. до 13ч. Добавлено 2ч на изучение темы «Химические реакции». В результате изучения химии на базовом уровне ученик должен знать/понимать важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология; основные законы химии: сохранения массы веществ, постоянства состава, периодический закон; основные теории химии: химической связи, электролитической диссоциации, строения органических соединений; важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы; уметь называть изученные вещества по «тривиальной» или международной номенклатуре; определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений; характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений; объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов; выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ; проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах; использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: объяснения химических явлений, происходящих в природе, быту и на производстве; определения возможности протекания химических превращений в различных условиях и оценки их последствий; экологически грамотного поведения в окружающей среде; оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы; безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием; приготовления растворов заданной концентрации в быту и на производстве; критической оценки достоверности химической информации, поступающей из разных источников. Тематическое планирование № Раздел 1 2 3 Строение атома и периодический закон Строение вещества Химические реакции 4 Вещества и их свойства 5 Химия и жизнь Резерв ИТОГО Количество часов 3 К/р П/р 1 - 10 10 1 - 9 1 1 2 1 34+1 3 1 Учебно – тематическое планирование № п/п Раздел. Тема урока 1-2 СТРОЕНИЕ АТОМА и СТРОЕНИЕ ВЕЩЕСТВА (3+10ч) 1.Основные сведения о строении атомов. 2.Строение электронных оболочек атомов. 3.ПЗ и ПСХЭМ. 4.Ионная химическая связь. 5.Ковалентная химическая связь. 6.Металлическая и водородная связь. 7.Полимеры. 8.Газообразные вещества. 9.Жидкие и твердые вещества. 10.Дисперсные системы 11.Чистые в-ва и смеси. Массовая доля компонента 12.Массовая доля раств. вещ-ва. 13.К/р №1 «Строение атома и строение Составляющие качества образования Предметно – информационная Ядро и электронная оболочка. Электроны, протоны, нейтроны. Правила заполнения электронных уровней. Периодический закон и ПСХЭМ. Ионная, ковалентная, металлическая и водородная связь. Кристаллические решетки. Причины многообразия веществ: гомология, изомерия, аллотропия. Определение и классификация дисперсных систем. Истинные и коллоидные растворы. Чистые вещества и смеси, способы их разделения. Растворы. Растворимость. Способы выражения концентрации растворов. Деятельностно – коммуникативная Знать: современные представления о строении атомов; «электронная орбиталь»; смысл и значение Периодического закона, горизонтальные и вертикал. закономерности и их причины. Классификацию хим. связи. Причины многообразия веществ. Определение и классификацию дисперсных систем. Понятия «истинные» и «коллоидные» рас-ры. Способы разделения смесей. Физич. и химич. теорию растворов. Уметь: составлять электрон. Формулы атомов; давать характеристику элемента на основании его положения в ПС; характеризовать свова вва по типу хим. связи и кристаллической решетки. Ценностноориентационная Значение знаний о строении атома, периодического закона и ПСХЭМ. Вклад Менделеева Д.И. в развитие науки. Значимость растворов в жизни человека, животных и растений. вещества». 3 ХИМИЧЕСКИЕ РЕАКЦИИ (10ч) 1.Классификация реакций. 2.Скорость химических реакций. 3.Обратимые реакции. 4Электролит. Диссоциация. 5.Гидролиз. 6.Биологическая роль гидролиза. 7.ОВР. 8.Составление ОВР. 9.Электролиз. 10.К/р №2 «Химические реакции». ВЕЩЕСТВА И ИХ СВОЙСТВА (9ч) 4 1.Металлы. 2.Неметаллы. 3.Оксиды. 4.Кислоты. 5.Основания. 6.Соли. 7.Генетическая связь. 8.Пр/р «Решение экспериментальных задач». 9.К/р № 3 «Вещества и их св-ва». ХИМИЯ И ЖИЗНЬ (2ч) 5 1.Общие представления о промышленных способах получения веществ. 2.Химия и окружающая среда. Бытовая химическая грамотность. 6 РЕЗЕРВ (1ч) Итого: 34ч+1ч резерв Классификация хим. реакций. Скорость химич. реакций. Факторы, влияющие на скорость рций. Обратимые и необратимые реакции. Химическое равновесие и условия его смещения. Электролитическая диссоциация. Сильные и слабые электролиты. РИО. Гидролиз. Водородный показатель. ОВР. Окисление и восстановление. Электролиз. Положение Ме и НеМе в ПСХЭМ, строение их атомов. Физические и хим. свойства. Способы получения металлов. Коррозия. Строение, классификация, номенклатура, свойства оксидов, гидроксидов, солей. Понятие о генетической связи и генетических рядах в неорганической химии. Качественные реакции. Общие промышленные способы получения веществ. Химическое загрязнение окружающей среды и его последствия. Вычислять массовую и объемную долю компонента в смеси, массовую долю растворенного вещества. Знать: понятие «скорость хим.реакции»; факторы, влияющие на скорость; классификацию хим. реакций понятие «хим.равновесие» и условия смещения; электролиты сильные и слабые; основные положения ТЭД; типы гидролиза солей; «окислитель» и «восстановитель». Уметь: устанавливать тип реакций; составлять уравнения диссоциации электролитов, РИО и ОВР; уравнения гидролиза солей (1 ступень). Знать: основные металлы и их свойства; основные неметаллы и их свойства; классификацию и номенклатуру оксидов, кислот, оснований и солей и их свойства. Уметь: характеризовать свойства Ме и НеМе, оксидов, кислот, оснований и солей; проводить качественные реакции на ионы; решать цепочки превращения веществ. Знать: промышленные способы получения веществ (на примере производства серной кислоты и аммиака), основные источники загрязнения окружающей среды и способы защиты. Значение знаний о скорости реакций, хим.равновесии в производстве, жизни человека. Роль электролитов. Значение ОВР. Роль металлов и неметалллов в жизни человека, способах предупреждения коррозии. Взаимосвязь между классами веществ. Положительная и отрицательная роль химического производства и роль человека в защите окружающей среды.