Требования к знаниям материала основного общего
реклама
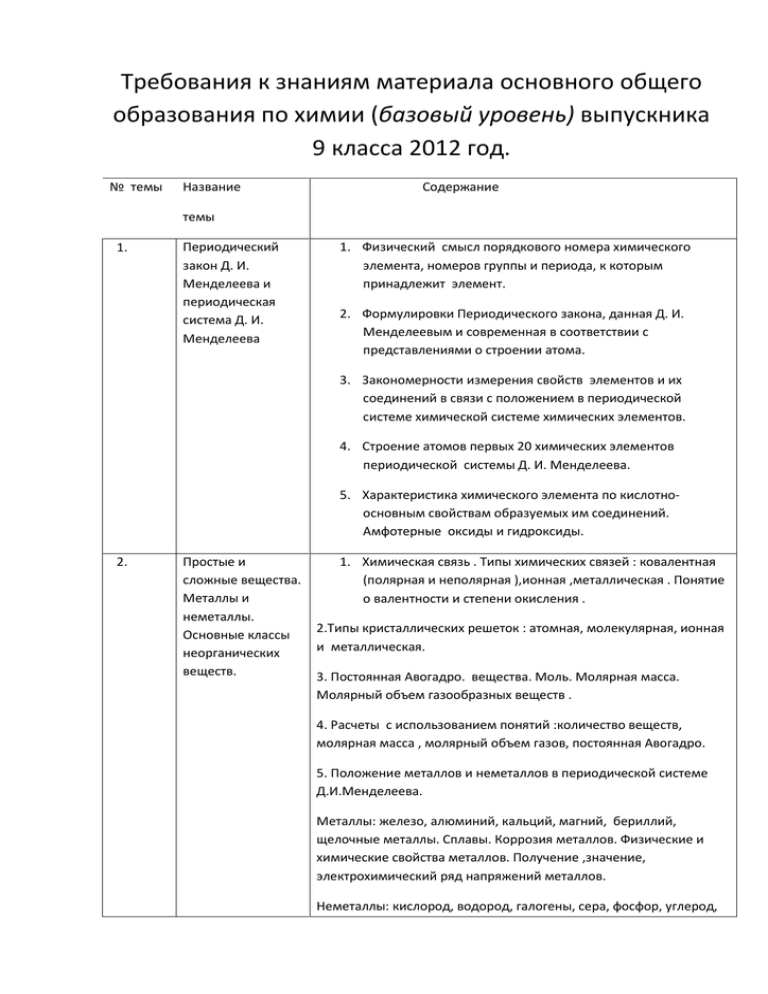
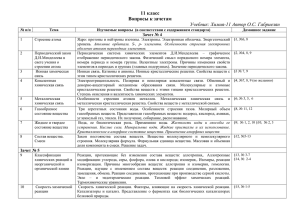
Требования к знаниям материала основного общего образования по химии (базовый уровень) выпускника 9 класса 2012 год. № темы Название Содержание темы 1. Периодический закон Д. И. Менделеева и периодическая система Д. И. Менделеева 1. Физический смысл порядкового номера химического элемента, номеров группы и периода, к которым принадлежит элемент. 2. Формулировки Периодического закона, данная Д. И. Менделеевым и современная в соответствии с представлениями о строении атома. 3. Закономерности измерения свойств элементов и их соединений в связи с положением в периодической системе химической системе химических элементов. 4. Строение атомов первых 20 химических элементов периодической системы Д. И. Менделеева. 5. Характеристика химического элемента по кислотноосновным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды. 2. Простые и сложные вещества. Металлы и неметаллы. Основные классы неорганических веществ. 1. Химическая связь . Типы химических связей : ковалентная (полярная и неполярная ),ионная ,металлическая . Понятие о валентности и степени окисления . 2.Типы кристаллических решеток : атомная, молекулярная, ионная и металлическая. 3. Постоянная Авогадро. вещества. Моль. Молярная масса. Молярный объем газообразных веществ . 4. Расчеты с использованием понятий :количество веществ, молярная масса , молярный объем газов, постоянная Авогадро. 5. Положение металлов и неметаллов в периодической системе Д.И.Менделеева. Металлы: железо, алюминий, кальций, магний, бериллий, щелочные металлы. Сплавы. Коррозия металлов. Физические и химические свойства металлов. Получение ,значение, электрохимический ряд напряжений металлов. Неметаллы: кислород, водород, галогены, сера, фосфор, углерод, кремний. Аллотропный модификаций простых веществ, их соединены. Значение, применение неметаллов и их соединений. 6.Оксид,основания,кислоты,солисостав,классификация,названия.Таблица растворимости кислот, оснований, солей в воде. 7.Расчёты по формулам химических веществ, связанные с использованием понятия массовая и объёмная доля. 3 Изменения, 1.Признаки и условия протекания химических реакций. Закон сохранения массы веществ. Происходящие с веществами 2.Типы химических реакций соединения, разложения, обмена, замещения. Понятия об экзо-и эндотермических реакциях. Скорость химических реакций. Катализаторы, каталитические и не каталитические реакции обратимые и необратимые. 3.Реакция замещения. Использования электрохимического ряда напряжений металлов для прогнозирования возможности протекания реакций между металлами и растворами кислот, металлами и растворами кислот, металлами и растворами солей. 4 Электролитическая диссоциация 1.основные положения электролитической диссоциации. Электролиты и не электролиты. Механизм диссоциации электролитов с различным типом химической связи. Степень электролитической диссоциации. Сильные и слабые электролиты. 2.Ионные уравнения реакций. Условия протекания реакций обмена между электролитами до конца в свете ионных представлений. 3.Свойства кислот, оснований. солей в свете теории электролитической 5. Окислительно 1.Окислитель, восстановитель, окисление, восстановление Восстановительные 2.состовления уравнений окислительно-восстановительных реакций, метод электронного баланса. реакции 3.свойства простых веществ металлов и неметаллов, кислот и солей в свете представлений об окислительно-восстановительных процессов 6. Расчетные задачи по химическим уравнениям: 1.вычессление массы или количества веществ по известной массы или количеству вещества одного из вступающих в реакцию веществ или продуктов реакции 2.Вычиление массы(количества вещества, объёма)продукта реакции, если известна масса исходного вещества, содержащего определённую долю примесей. 3.Вычесление массы(количества вещества, объёма)продукта реакции, если известна масса раствора и массовая доля растворенного вещества 7. Органические вещества 1.Вещества – органические, многообразие органических соединений. 2.Причины многообразия органических веществ. Изомеры. 3.понятия гомологи, гомологический ряд. 4.придельные углероды: метан, этон. Свойства. Применения природных источников углеводород. 5.Непридельные углеводороды – этилен. Двойная связь. Реакция дегидратация, полимеризация, гидротация. 6.Спирты. Придельная одноатомные: метанол. Этонол. Трехактный спирт – глицерин. Функциональная группа. Двух атомный спирт – этиленгликоль . Качественная реакция на спирты. 7.Придельная одноосновные карбоновые кислоты – уксусноя кислота. Жирные кислоты – пальмитиновая, стеариновая. Реакция э этеридгикации. Сложные эфиры. 8. жиры – сложные эфиры глицирина и жирных кислот. Мыло. 9.Аминокислоты – строение. Реакция поликондексации. Белки, строения, беологическая роль. Качественная реакция на белки. 10.Углеводы. Моносахориды: глюкоза. Фруктоза. Диосахориды: сахороза. Полисахориды: крахмал, целлюлоза. Качественная реакция на крохмал.