okxidy ugleroda 2x
реклама

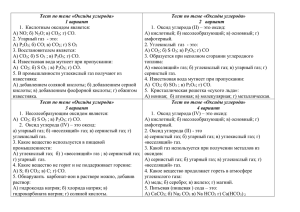
Выполнить задание. Ответить на вопросы. Задание 2. Составьте несколько предложений, чтобы получился небольшой рассказ к любому из этих изображений Задание 3. Опишите процесс, изображенный на фотографии. Задание 4. Поиграем в игру «Верите мне, или нет». Я буду называть какие-то утверждения, вы должны согласиться со мной или нет, свой ответ аргументировать. 1.Графит – прозрачный камень, очень твердый. 2.Из алмаза изготавливают электроды, так как он хорошо проводит электрический ток. 3.Алмаз, графит и карбид алюминия – это аллотропные вещества. 4.В противогазе применяют активированный уголь. 5.Адсорбция – это один из способов шлифовки алмазов. Задание 5. Вспомните положение атома углерода в ПСХЭ и зарисуйте строение его атома, в каких случаях он становиться окислителем, в каких – восстановителем. CO – оксид углерода (II), угарный газ. Определите степени окисления у обоих атомов, количество электронов переданных углеродом и количество электронов полученных кислородом. При таком раскладе сил у углерода не будет заветной восьмерки, своих четыре электрона и общих с кислородом тоже два. Как быть? Очевидно, атому кислорода придется передать в общее пользование одну свою свободную электронную пару, т.е. выступить в качестве донора, акцептором, разумеется, будет углерод. Таким образом, ковалентных связей будет три: две связи образованы обменным способом и одна донорно- акцепторным способом. Проблемный вопрос: исходя из строения молекулы попробуйте спрогнозировать свойства СО. Вариант ответа: углерод потерял не все свои электроны, а только два, значит он может стать восстановителем, отдав при этом еще два электрона, находящихся на внешнем энергетическом уровне. Такое возможно с такими окислителями как кислород, галогены и даже оксиды металлов (слайд №8): 2CO +O2 = 2CO2 (углекислый газ) CO +Cl2 =COCl2 (фосген) CO +FeO =CO2 +Fe Оксид углерода(II) – несолеобразующий оксид, восстановитель. Но ведь атом углерода, может, очевидно, и забирать у восстановителей электроны? Как вы думаете, какой атом может уступить электроны? Предположение, что это может быть водород, обладающий низкой ЭО : СO +2H2 =CH3 OH (метанол) Получение угарного газа и его физические свойства. На экране демонстрируем опыт ( слайд №9), т.к. газ токсичный. Используя учебник п. 29,и сайд учащиеся записывают самостоятельно физические свойства СО и уравнение реакции: HCOOH =CO +H2 O Переходим к оксиду углерода (IV). Изучение начинаем со строения молекулы и зарисовываем схему: O=C=O Связь полярная ковалентная, молекула неполярная, так как имеет линейное строение. Проблемный вопрос: углекислый газ используют в кислотных огнетушителях Все ли можно потушить углекислым газом? Есть ли вещества, которые могут гореть в атмосфере углекислого газа? Записываем реакцию: СO2 + Mg =MgO + C Оксид углерода (IV) – это типичный кислотный оксид: взаимодействует со щелочами, с основными оксидами и водой. Напишите уравнения, характеризующие его свойства. Подведем итог нашему уроку, проведем графический диктант. На столах у учащихся листы с вопросами, где нужно поставить + или - . Творческое задание. Возьмите интервью у одного из оксидов углерода со словами: « Уважаемый угарный газ….. или «Уважаемый углекислый газ…. ПРИЛОЖЕНИЕ № 1 Карта – схема вопросы 1.Строение молекулы 2.Физические свойства 3.Химические свойства 4.Получение 5. Применение СО – угарный газ СО2 – углекислый газ ПРИЛОЖЕНИЕ №2 Лабораторная работа «Получение углекислого газа и исследование его свойств» 1. В пробирку внесите несколько кусочков мрамора и прилейте немного разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2-3 мл известковой воды. 2. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа. 3. Опустите трубку в другую пробирку с 2- 3 мл дистиллированной воды и пропустите через нее газ. Через несколько минут выньте трубку из раствора, добавьте к полученному раствору несколько капель раствора синего лакмуса. 4. Что происходит, если на мрамор подействуют соляной кислотой? 5. Почему при пропускании углекислого газа через известковую воду происходит сначала помутнение раствора, а затем растворение взвеси? 6. Что происходит при пропускании оксида углерода (IV) через дистиллированную воду? 7. Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде. Описание конкурсных материалов Автор ( ФИО, ОУ,должность название Форма Учебный предмет, класс Название темы или раздела учебного курса Программные средства, с помощью которых создан дидактический материал Цели и задачи дидактического материала Содержание дидактического материала Ресурсы дидактического материала Используемые источники информации Возможности использования дидактического материала: - педагогом на уроке -учащимися Сирашева Любовь Михайловна, МОУ средняя общеобразовательная школа №35 Ленинского района городского округа г. Уфа РБ, учитель химии Оксиды углерода Презентация, конспект урока с приложениями, тест. Неорганическая химия, 9 класс Раздел «Неметаллы», тема «Углерод» Microsoft Office Word, Power Point Активизировать познавательную деятельность учащихся ДМ соответствует базовой образовательной программе по химии, в комплект ДМ включены картысхемы, инструкции по выполнению лабораторной работы, реактивы и оборудование для ее выполнения, графический диктант на слайде, слайды по выполнению различных упражнений, анаграммы и слайд по развитию критического мышлении у учащихся. Видео- фото, графические изображения, видеосюжеты сопровождаются звуком, на презентационных слайдах применяется анимация Методическая литература, Интернет Урок построен так, что дидактический материал можно использовать на всех этапах урока и педагогом, и учащимися.