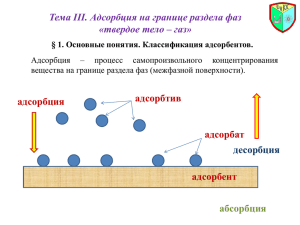
15. Равновесие фаз при искривленной поверхности раздела. Уравнение Лапласа. Уравнение Томсона. Изотермы адсорбции на пористых телах. Влияние структуры пористого тела на адсорбцию. Понятие капиллярно –конденсационного гистерезиса. Вследствие избыточной поверхностной энергии и благодаря своей подвижности, в условиях невесомости жидкости приобретают сферическую форму (вода в земных водоемах имеет плоскую ровную поверхность только потому, что на нее действует сила тяжести). С появлением кривизны поверхности раздела (радиусом r) возникает дополнительное внутреннее давление Δр. Его можно представить как рассчитанную на единицу поверхности равнодействующую сил поверхностного натяжения σ, сходящихся в точке О (рис.8). Равнодействующая сил (а следовательно, и внутреннее давление) направлена перпендикулярно к поверхности в центр кривизны. Под действием этой силы совершается работа по уменьшению объема тела, которая может быть выражена как ΔрdV , где dV – изменение объема тела. Эта работа совершается в результате уменьшения поверхностной энергии ΔdS. Процесс превращения поверхностной энергии в механическую опишем с помощью фундаментального уравнения термодинамики, записанного относительно энергии Гельмгольца, Уравнение (40) в общем виде передает влияние кривизны поверхности на внутреннее давление, которое по своему физическому смыслу, представляет разность давления внутри тел с изогнутой и плоской поверхностями (или, что то же самое, – разницу давлений насыщенного пара над изогнутой и плоской поверхностями жидкости, с которой пар находится в равновесии). Из уравнения видно, что чем больше поверхностное натяжение, тем влияние кривизны поверхности значительнее. Для поверхности, имеющей правильную сферическую форму, dS/dV = 2/r ; для цилиндрической поверхности (длиной цилиндра l и радиусом r ) dS/dV = 1/r. Покажем это на примере сферической поверхности: S , следовательно, dS/dV = 2/r. Уравнение (40) для сферической и цилиндрической поверхностей соответственно принимает вид Для поверхности неправильной формы уравнение (40) принимает вид , где 1 /r 1 и 1/r 2 – кривизна главных нормальных сечений 1 и 2. Знаки в уравнениях (41) – (43) учитывают характер кривизны поверхности: знак «+» соответствует выпуклой поверхности, а знак «-» соответствует вогнутой поверхности. Легко убедиться, что уравнение (43) для сферы (r 1 = r 2 ) переходит в выражение (41), а для цилиндрической поверхности (один из радиусов кривизы равен бесконечности) - в уравнение (42). Уравнения (40) – (43), связывающие кривизну поверхности с изменением внутреннего давления, известны как уравнения Лапласа. Уравнение Томсона Вследствие существования лапласова давления величина давления насыщенного пара жидкости при данной температуре будет зависеть от формы поверхности. Эта зависимость определяется уравнением Томсона, которое устанавливает связь между давлением насыщенного пара над плоской и искривленной поверхностями. Уравнение Томсона, как и уравнение Лапласа, является одним из основных уравнений физической химии поверхностных явлений. Обозначим через r радиус кривизны сферической поверхности раздела фаз (радиус капли) РS и Р – давление насыщенного пара над плоской (r=∞) и выпуклой поверхностями (рис.9). Перенесем некоторое количество жидкости dm с плоской поверхности жидкости в каплю радиуса r путем последовательных операций: 1) обратимого изотермического испарения жидкости с плоской поверхности при давлении РS ; 2) обратимого сжатия пара от давления РS до давления Р и 3) последующей конденсации пара в каплю при давлении Р. Поскольку работа испарения и работа конденсации в этих условиях равны по величине и противоположны по знаку, то общая работа переноса dW , совершаемая над системой, оказывается работой изотермического сжатия пара. Считая пар идеальным газом и принимая во внимание, что Число молей переносимого вещества определим как n =dm/M, где М – молярная масса жидкости. Так как масса капли радиуса r Поверхность капли S=4π2r 2 и dS=8 πrdr. Подставляя эти выражения в уравнение (44) и учтя, что M/ ρ= vm – молярный объем жидкости, получим С другой стороны, при переносе dm вещества вследствие увеличения объема капли происходит увеличение поверхности и при этом совершается работа увеличения поверхности Работа совершается против сил поверхностного натяжения и в рассматриваемом нами случае равна Величины этих работ равны и противоположны по знаку: W= -W^, поэтому, для давления насыщенного пара над выпуклой поверхностью шаровидного мениска получим При выводе соотношения, описывающего изменение давления насыщенного пара над вогнутой поверхностью, необходимо учесть, что это давление меньше, чем над плоской поверхностью (уравнения (41) – (43)), поэтому при переносе вещества следует совершить работу расширения (а не работу сжатия, как в рассмотренном выше случае). Проводя уже знакомые преобразования, приходим к выражению для давления насыщенного пара над вогнутой поверхностью шаровидного мениска Аналогично можно получить уравнение для выпуклой цилиндрической поверхности. Масса капли цилиндрической формы m = ρVцил. = ρπr2l, где l – высота цилиндра, dm = ρ2πrldr. Площадь цилиндрической поверхности S=2πrl и dS=2πldr. Подставляя эти соотношения в уравнения (44) и (46), получим Давление насыщенного пара над вогнутой цилиндрической поверхностью будет иметь вид Уравнения (47) – (50) называются уравнениями Томсона. Анализ полученных Томсоном уравнений позволяет сделать следующие выводы. - Давление насыщенного пара жидкости над плоской поверхностью (r=∞) больше давления над вогнутой поверхностью и меньше давления над выпуклой поверхностью. Это означает, что процессы капиллярной конденсации адсорбата в порах адсорбента будут протекать при иных давлениях, чем в случае непористого адсорбента. Если адсорбат смачивает стенки пор адсорбента, то в порах происходит образование вогнутого мениска, и давление, при котором протекает конденсация, будет меньше, чем для случая плоской поверхности. Если в поре образуется выпуклый мениск, то заполнение поры в результате капиллярной конденсации возможно только при более высоких давлениях. - Сравнение уравнений (48) и (50) для вогнутого мениска показывает, что давление насыщенного пара над цилиндрическим мениском больше, чем над шаровидным мениском у капилляра с тем же радиусом. Это обстоятельство играет существенную роль при анализе процессов капиллярной конденсации в пористых телах. - Для случая смачивающей жидкости (вогнутая поверхность раздела поверхностный слой / газовая фаза) по мере повышения давления будет происходить заполнение пор в порядке возрастания их размеров. Влияние структуры пористого тела на адсорбцию. В отличие от адсорбции на телах с ровной поверхностью адсорбция на пористых телах существенно зависит от структуры тела, от его пористости и размера пор. Положительная адсорбция на пористых телах возможна при наличии достаточного сродства между адсорбентом и адсорбатом необходимого для обеспечения смачиваемости поверхности. При малых давлениях закономерности адсорбции в макропористых и переходно-пористых адсорбентах как и для ровной поверхности, определяются, главным образом, природой взаимодействующих компонентов. Адсорбцию в этой области давлений для указанных систем описывают уравнения Генри, Ленгмюра и БЭТ. Микропористая структура обеспечивает резкое увеличение потенциала адсорбции благодаря перекрытию поверхностных сил, поэтому для увеличения адсорбционной способности адсорбентов при малых давлениях изменяют структуру адсорбентов, превращая их в микропористые тела. Ярким примером является активирование углей. Адсорбцию на тонкопористых адсорбентах описывают уравнения теории объемного заполнения микропор. С увеличением давления газа или пара в телах с переходными порами начинают действовать капиллярные силы. В связи с этим адсорбционная активность в переходно-пористых телах возрастает по сравнению с макропористыми и непористыми адсорбентами. Чем меньше размер пор, тем при более низких давлениях происходит их заполнение. В этой области давлений закономерности адсорбции в переходно-пористых телах определяются уравнением Томсона. Адсорбция на непористых и макропористых адсорбентах во всей области давлений, как правило, описывается адсорбционными уравнениями теории БЭТ. Избирательность (селективность) адсорбции определяется природой подлежащих разделению газов и паров. При малых давлениях решающим фактором является сродство к поверхности адсорбента. Чем выше это сродство, тем больше теплота адсорбции, тем выше значение константы равновесия адсорбции, тем выше адсорбция. Большая разница между сродством разделяемых адсорбатов по отношению к адсорбенту обеспечивает эффективное разделение газовой смеси. Для микропористых адсорбентов дополнительную роль играет молекулярноситовый эффект. В области давлений, обеспечивающих начало капиллярной конденсации, основное влияние на разделение газов начинает оказывать их способность к конденсации, а следовательно, такие параметры, как критическая температура и температура кипения. Чем выше эти температуры, тем при меньшем давлении начинается конденсация газа, тем лучше он будет адсорбироваться пористым телом. Структура пористого тела в значительной степени может влиять на кинетику адсорбционного процесса. Скорость физической адсорбции на непористых телах весьма высока. Во многих случаях адсорбционное равновесие достигается за 10-20 секунд, причем до 95 % адсорбата связывается поверхностью за 1-2 с. В этом случае скорость процесса определяется скоростью подвода вещества к границе раздела фаз (внешняя диффузия). При адсорбции на пористых телах появляется стадия переноса вещества внутри пор (внутренняя диффузия), для которой характерен, главным образом, диффузионный механизм. Часто эта стадия определяет скорость всего адсорбционного процесса и может быть весьма длительной в зависимости от формы и размера пор. Изотермы адсорбции на пористых телах Пористая структура адсорбента разнообразна. Однако считается, что ее можно смоделировать тремя видами пор: 1) конусообразными; 2) цилиндрическими с одним открытым концом (форма пробирки); 3) цилиндрическими с двумя открытыми концами (рис.10) Остановимся более подробно на изотермах, характеризующих процессы адсорбции и капиллярной конденсации в модельных порах жидкости, смачивающей поверхность адсорбента (рис.10). Характерный вид изотерм приведен на этом же рисунке. Прежде, чем мы рассмотрим характерные особенности изотерм, подчеркнем, что во всех случаях на начальных этапах на стенках пор идет полимолекулярная адсорбция, приводящая к образованию адсорбционных пленок с вогнутой поверхностью. Процесс капиллярной конденсации в конусообразных порах (рис.10,а) начинается со дна поры, где кривизна мениска максимальна. По мере заполнения поры радиус мениска увеличивается (кривизна уменьшается), поэтому (см. уравнение (48)) для дальнейшего заполнения поры необходимо увеличить давление. Процесс десорбции жидкости протекает таким же путем, т.е. капиллярная конденсация в конусообразных порах полностью обратима. В порах цилиндрической формы (рис.10,б), закрытых с одного конца (форма пробирки), в процессе адсорбции образуется шаровидный мениск. Заполнение поры также начинается со дна поры. В отличие от конусообразной поры здесь, начавшись, капиллярная конденсация протекает при одном давлении, поскольку радиус шаровидного мениска по мере заполнения поры не изменяется. На изотерме капиллярной конденсации этой стадии соответствует вертикальный участок. Стадия заканчивается формированием на открытом конце поры шаровидного мениска с rш = rпоры. Повышение давления адсорбтива до РS приведет к дальнейшему заполнению поры, сопровождающемуся снижением кривизны сферического мениска и образованием плоской границы раздела. Величины адсорбции, соответствующие этой стадии, невелики. Как и в первом рассмотренном случае, процесс десорбции полностью обратим. Наконец, в цилиндрических порах, открытых с обоих концов (рис.10,в), шаровидный мениск на начальных стадиях адсорбции образоваться не может. Конденсация начинается на вогнутой, цилиндрической поверхности при давлении РЦ РS exp( vm rRT ) . Конденсация на стенках цилиндрической поры приводит к увеличению толщины пленки и уменьшает диаметр поры. Это приводит к ее последующему заполнению при давлении, отвечающем началу конденсации. Пар как бы все время оказывается пересыщенным по отношению к вновь формирующейся в процессе заполнения поры поверхности. Изотерма капиллярной конденсации, как и в первом случае, будет иметь вертикальный участок. Однако сравнение уравнений (48) и (50) показывает, что при равных размерах цилиндрической закрытой с одного конца и цилиндрической открытой с двух концов пор заполнение последней будет происходить при более высоких величинах давления адсорбата. Это связано с тем, что заполнение поры – «пробирки» происходит за счет конденсации пара на шаровидном мениске, в то время как заполнение открытой с обоих концов поры происходит на вогнутой цилиндрической поверхности, а РцРш при равных значениях r (см. уравнения (48) и (50)). После заполнения на концах открытой поры образуются шаровидные мениски, кривизна которых будет определяться значением радиуса кривизны, соответствующего давлению Рц. Из уравнения (48) следует rш 2 vm (51) Рц RT ln РS При этом, применяя уравнения (48) и (50), легко показать, что при одинаковых величинах относительного давления насыщенного пара адсорбтива (Рц=Рш)rщ=2 rц, где rц – радиус цилиндрической поры. При дальнейшем повышении давления от Рц до РS кривизна шаровидных менисков будет уменьшаться до нуля, что будет соответствовать кривизне плоской поверхности. Дополнительно сконденсируется небольшое количество пара. При десорбции вначале процесс пойдет обратимо. При испарении небольших количеств жидкости в устья капилляра будут вдавливаться шаровидные мениски растущей кривизны. Однако при Р = Рц эти мениски еще прорваться не могут, в результате капилляры остаются заполненными. Как было указано выше, давление пара, при котором начинается процесс капиллярной конденсации в такой поре, всегда больше того, которое требуется для продолжения процесса. Согласно (50), давление насыщенного пара над цилиндрической поверхностью, необходимое и достаточное для конденсации адсорбтива, должно уменьшаться с ростом кривизны поверхности вогнутого цилиндрического мениска, который происходит по мере заполнения поры. В результате этого только при снижении давления пара до Р РШ РЦ ,0 РS exp( 2 vm ) , (52) rRT радиус шаровидного мениска станет равным радиусу адсорбционной пленки в цилиндрическом капилляре, и вся жидкость, заполнявшая капилляр, испарится. Процессы заполнения и опорожнения открытой с двух сторон цилиндрической поры можно проиллюстрировать с помощью рис.11. На этом рисунке приведена функция вида Р=РS exp(-x) (где x1/r), соответствующая виду уравнений (48) и (50). Начало конденсации пара в цилиндрической поре начинается в точке в, соответствующей давлению Р=Рц, определяемому как давление насыщенного пара для цилиндрической поверхности с r=rц (уравнение (50)). По мере заполнения радиус поры уменьшается и соответственно растет величина х. Это означает, что достигнутое давление Рц всегда оказывается выше давления насыщенного пара, которое требуется для продолжения процесса конденсации на вновь формирующейся в процессе заполнения поры цилиндрической поверхности. Таким образом, пар будет пересыщенным во время заполнения поры. Поддерживая давление Р=Рц, мы достигнем заполнения цилиндрической поры в результате слияния растущих навстречу друг другу слоев жидкости и формирования на концах поры шарообразных менисков с rш =2 rц. Далее, при повышении Р до РS (в точке а) происходит окончательное заполнение поры, сопровождающееся снижением кривизны сферических менисков. Процесс завершается формированием плоской поверхности раздела. Опорожнение поры идет следующим путем. Первоначально при снижении давления от РS (в точке а) до Рц (в точке в) происходит обратимая десорбция адсорбата вплоть до образования на концах поры шаровидных менисков с rш =2 rц. Однако дальнейшее опорожнение поры становится возможным только при давлении Р=Рц0, соответствующем образованию сферического мениска с rш = rц (точка с), поскольку закономерности испарения вещества из поры на этом этапе подчиняются закономерностям испарения вещества из поры формы пробирки (открытой с одного конца цилиндрической поры). Сравнение уравнений (50) и (52), определяющих величины давлений, соответствующих процессу капиллярной конденсации (Рц) и испарения (Рц0) при r = rц, показывает, что десорбционная ветвь разойдется с адсорбционной ветвью. Получится характерная петля капиллярно-конденсационного гистерезиса (рис.10,в). Опорожнение поры при Р=Рц0, по-видимому, можно представить себе следующим образом. При понижении давления до Рц0 начинается испарение жидкости с обоих концов поры и движение шаровидных менисков навстречу друг другу вплоть до их слияния. После этого происходит разрыв сплошности жидкой фазы внутри поры. Граница раздела жидкость / газ превращается из сферической в цилиндрическую. Необходимо подчеркнуть, что при давлении Р=Рц0 пар всегда будет ненасыщенным по отношению к испаряющейся с поверхности вогнутого цилиндрического мениска жидкости вплоть до момента, когда вновь на поверхности поры образуется адсорбционная пленка. Далее процесс десорбции вновь станет обратимым и будет подчиняться закономерностям полимолекулярной адсорбции. Таким образом, появление адсорбционно-десорбционного гистерезиса связано с тем, что при десорбции опорожнение поры происходит в результате испарения жидкости с поверхности сферического мениска с r2 = rц (при Р=Рц0), а не с поверхности сферического мениска с r1 = 2rц, который формируется в прямом процессе при давлении, соответствующем началу конденсации и заполнения поры (при Р=Рц). Из уравнения (50) видно, что при r2 r1 величины давлений соотносятся между собой как Рц0 Рц. Реальные адсорбенты не обладают столь однородной структурой. Для них характерно наличие пор различной формы и размеров, которые заполняются и опорожняются при разных давлениях. В связи с этим реальные изотермы адсорбции имеют наклонные ветви гистерезиса (рис.12). Капиллярная конденсация описывается уравнением Томсона, в которое входит радиус кривизны мениска что позволяет использовать его для расчета функции распределения пор по размерам. Для получения кривых распределения по методу капиллярной конденсации используют десорбционную ветвь изотермы. Это обусловлено тем, что для всех без исключения пор она соответствует сферическим менискам, в то время как адсорбцонная ветвь – как шаровидным, так и цилиндрическим. Радиусы сферических менисков принимают за радиусы пор. Каждой точке десорбционной кривой соответствуют определенные величины адсорбции амоль/г и относительного давления пара адсорбтива Р/РS . Зная величину адсорбции, можно вычислить объем заполненных при данном давлении пор Vп=аvm , где vm - молярный объем жидкости. Эффективный радиус сферического мениска, соответствующий данному относительному давлению пара, находят по уравнению Томсона r 2 vm . Р RT ln PS Поскольку поры заполняются в результате капиллярной конденсации после полимолекулярной адсорбции, то истинное значение радиуса пор складывается из радиуса мениска rм и толщины адсорбционного слоя t адс.: r = rм + t адс Величину tадс. определяют в независимом опыте при том же давлении адсорбата, но на непористом (макропористом) адсорбенте, чтобы исключить явление капиллярной конденсации. Далее, зная а моль/г и величину удельной поверхности непористого адсорбента Sуд. , рассчитывают tадс.: t адс. = а vm/ Sуд.. Зная Vп и соответствующие ему значения r , строят интегральную кривую распределения, которая выражает зависимость общего объема пор от их радиуса Vп=f(r). Типичный вид интегральной кривой распределения представлен на рис.13. Далее, с помощью графического дифференцирования кривой Vп=f(r) рассчитывают дифференциальную кривую распределения (рис.14), представляющую собой зависимость f(r) = (dVп/dr) от r. Площадь заключенная между осью абсцисс, дифференциальной кривой и ординатами r1 и r2 определяет объем пор, размеры которых лежат в пределах от r1 до r2, т.е. по сути определяют объем данной фракции пор. Зная общую пористость адсорбента, можно рассчитать зависимость доли объема пор данного радиуса от общего объема пор. Дифференциальная кривая распределения может быть построена и в r2 координатах = (dVп/dr)(1/Vп) от r. В этом случае величина dr означает долю объема пор r1 данного размера от общего объема пор. Чем резче выражен максимум и уже дифференциальная кривая распределения, тем более однородным по размерам пор является адсорбент. Удерживание газов и паров пористыми телами зависит как от структуры пористого тела, так и от природы взаимодействующих адсорбата и адсорбента. Основываясь на закономерностях капиллярных явлений, можно утверждать, что такое сродство должно быть достаточным, чтобы поверхность пористого тела смачивалась жидкостью, появляющейся в результате конденсации пара в порах. Только в этом случае будет формироваться вогнутая поверхность раздела пар/адсорбированная жидкость, и капиллярные силы будут способствовать увеличению адсорбционной способности пористого тела. При этом, чем меньше размер пор (а следовательно, выше кривизна образующегося вогнутого мениска), тем сильнее капиллярное удерживание адсорбата и тем при более низких относительных давлениях пара начнется процесс конденсации. Процесс десорбции будет протекать при меньших давлениях. В противном случае, если поверхность не смачивается адсорбатом, наблюдается капиллярное выталкивание вещества из пор. Появление выпуклого мениска приводит не к понижению, а к повышению давления насыщенного пара по сравнению с давлением насыщенного пара над плоской поверхностью. Это означает, что процесс конденсации пара над выпуклой поверхностью становится возможным только при более высоких относительных давлениях сорбата. Соответственно процесс десорбции будет протекать при более высоких давлениях. Рассмотренные закономерности следуют из анализа уравнения (47). В результате адсорбция в таких системах минимальна и, как правило, возможна только на ровной поверхности и в крупных порах. 16. Теория объемного заполнения микропор. Применение основных положений теории Поляни в теории ТОЗМ для расчета изотерм адсорбции. Уравнения Дубинина и Дубинина-Радушкевича. Практическое использование адсорбции газов и паров. Теория объемного заполнения микропор. Ранее уже отмечалось, что размеры микропор соизмеримы с размерами адсорбирующихся молекул. Результатом этого является 1) перекрывание полей адсорбционных сил противоположных стенок пор, что значительно повышает энергию адсорбции; в результате наблюдается резкое возрастание адсорбции в области малых давлений адсорбата (поля поверхностных сил действуют во всем объеме поры); 2) взаимодействие большинства адсорбированных молекул непосредственно с поверхностью адсорбента (рис.15); 3) объемное заполнение адсорбционного пространства (рис.15,а); 4) более высокая, чем для переходно-пористых адсорбентов, избирательность (селективность) адсорбции. Это связано с проявлением так называемого ситового эффекта, который заключается в том, что адсорбироваться на микропористом адсорбенте могут только те молекулы, размеры которых меньше размеров микропор или, в крайнем случае, равны им. В соответствии с этим микропористые адсорбенты часто называют молекулярными ситами. Адсорбционные процессы на микропористых адсорбентах описываются на основании теории объемного заполнения микропор (ТОЗМ). Переходя к количественным соотношениям ТОЗМ, необходимо отметить, что в ее основе лежат представления потенциальной теории Поляни, предложенной им для описания полимолекулярной адсорбции. Применение основных положений теории Поляни в теории ТОЗМ для расчета изотерм адсорбции. На основе теории Поляни была создана современная теория – ТОЗМ. Прежде всего, было постулировано, что эта теория относится только к микропористым адсорбентам. Несколько иной смысл был придан адсорбционному потенциалу. В ТОЗМ его рассматривают как разность химических потенциалов газа при давлении РS и давлении Р. При давлении РS химические потенциалы жидкости и находящегося с ней в равновесии насыщенного пара равны между собой .Тогда физический смысл адсорбционного потенциала может быть определен как работа переноса одного моля газа с поверхности жидкого адсорбата (давление РS ) в равновесную газовую фазу (давление Р). Принимая во внимание выражение для химического потенциала Этот потенциал характеризует работу против адсорбционных сил. Каждой точке изотермы адсорбции соответствуют определенные значения а ([моль/г], [моль/см 2] и т.д.) и Р/РS . , которые позволяют рассчитать соответственно величины V и ε. Значения адсорбционного объема рассчитывается как Таким образом, на основании экспериментально полученной изотермы можно построить характеристическую кривую. Вследствие температурной инвариантности характеристической кривой возможен пересчет изотермы адсорбции для любой другой температуры. Для двух различных температур Т1 и Т2 можно записать Уравнения Дубинина и Дубинина-Радушкевича. М.М. Дубининым было обнаружено еще одно важное свойство потенциальных характеристических кривых. Оно заключается в том, что характеристические кривые для одного и того же адсорбента и разных адсорбатов при всех значениях V находятся в постоянном отношении β получил название коэффициента аффиности. Отсюда следует, что получив экспериментально изотерму адсорбции какого-либо газа при заданной температуре и построив на основании ее результатов характеристическую кривую, мы имеем возможность с помощью коэффициента аффиности вычислить характеристическую кривую второго адсорбата на том же адсорбенте. Знание этой характеристической кривой позволяет нам рассчитать изотермы адсорбции второго адсорбата на заданном адсорбенте при любой температуре. Видно, какие широкие возможности предоставляет ТОЗМ. На основании положений теории Поляни и обобщения большого экспериментального материала, Дубининым также было получено аналитическое выражение для изотермы адсорбции Уравнение (55) является общим уравнением ТОЗМ. Дубинин и Радушкевич положили потенциальную теорию Поляни в основу теории адсорбции газов на микропористых адсорбентах. Вместо понятия «адсорбционный потенциал» они предпочитали использовать термин «дифференциальная молярная работа адсорбции», что, несомненно, терминологически более правильно. Одна из основных предпосылок теории, развитой Дубининым и Радушкевичем, — не послойная адсорбция на стенках пор адсорбента, а объемное заполнение пор. Поэтому вторым параметром для описания адсорбции на микропористых адсорбентах является степень заполнения микропор, определяемая выражением Учитывая, что в микропорах поля адсорбционных сил перекрываются, Дубинин и Радушкевич приняли предположение, что распределение степени заполнения микропор по дифференциальной молярной работе адсорбции описывается гауссовой кривой. Такое предположение приводит к выражению где k — некоторая постоянная, зависящая от природы адсорбата и адсорбента. Учитывая уравнение (1.3.55), можно записать или где D = k(2,3RT)2 — постоянная уравнения Дубинина — Радушкевича. Практическое использование адсорбции газов и паров. - разделение газовых смесей; - рекуперация растворителей, выбросы которых разными промышленными предприятиями оцениваются в сотни тысяч тонн (несмотря на малые концентрации растворителей в отходящих газах, степень извлечения их на активных углях составляет 90-95 %); - очистка воздуха. - Н.Д. Зелинский впервые предложил использовать активные угли для поглощения отравляющих газов (противогаз); - осушка газов (для осушки чаще всего применяют силикагели, алюмогели, цеолиты); - газовая адсорбционная хроматография. Адсорбция газов и паров обусловливает и сопровождает многие промышленные и природные процессы. Так, адсорбция компонентов является важнейшей стадией любой гетерогенной реакции. Огромную роль она играет в гетерогенном катализе. Питание растений диоксидом углерода из воздуха связано с предварительной и обязательной стадией адсорбции газа на листьях. Дыхание человека и животных протекает также благодаря предварительной адсорбции кислорода на легких. Общая площадь легочных альвеол у человека составляет в среднем 90 м2 . У одноклеточных и некоторых многоклеточных организмов (например, у плоских червей) дыхание осуществляется всей поверхностью тела. 17. Адсорбция на границе раствор – газ. Особенности адсорбции на границе жидкость – газ. Зависимость поверхностного натяжения от природы и концентрации растворенного вещества. Поверхностно-активные вещества. На границе раздела жидкость-газ могут самопроизвольно адсорбироваться молекулы поверхностно-активных веществ. Они формируют пограничное адсорбционные слои, кот-ые способны радикально изменять св-ва поверхности раздела фаз и дисперсных систем. Адсорбция приводит к изменению поверхностного натяжения. Эти изменения зависят от концентрации адсорбатива и графически выражаются при помощи изотерм поверхностного натяжения и адсорбции. Способность вещества при адсорбции на границе раздела фаз изменять поверхностное натяжение в зависимости от его концентрации в объеме называются поверхностью активностью. Она определяется знаком и значением отношения , которое входит в фундаментальное уравнение адсорбции Гиббса. Значение этой производственной непостоянной и зависит от концентрации растворенного вещества. , где g – величина поверхностной активности вещества. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы: 1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно-активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. 2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды 4 между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение. 3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза). Особенности адсорбции на границе жидкость – газ. Поверхность жидкости в отличие от поверхности твердого тела является однородной и гладкой. Это означает что на поверхности отсутствуют какие-либо особые участок, отличающиеся в энергетическом или геометрическом плане от других участков поверхности, все участки поверхности равноценны. В силу подвижности жидкости нельзя также говорить о закреплении молекул адсорбата в строго определённых местах, в результате теплового движения молекулы адсорбата могут перемещаться по межфазной поверхности. Таким образом, в отличие от локализованной адсорбции на активных центрах твердого тела, исчезают основания рассматривать адсорбцию на жидкой поверхности, как локализованную адсорбцию. Целесообразно рассматривать явления адсорбции на границе раздела жидкий раствор – газ в рамках термодинамического подхода, как процесс растворения адсорбата в приповерхностных межфазных слоях Поверхностно-активные вещества. Все растворимые вещества по их способности адсорбироваться на границе раздела раствор – газ (воздух) можно разделить на две группы : поверхностно-активные вещества (ПАВ) и поверхностно-инактивные вещества. ПАВ способны накапливаться в поверхностном слое и, следовательно, характеризуются положительной адсорбцией Г>0. ПАВ должны обладать поверхностным натяжением, меньшим, чем поверхностное натяжение чистого растворителя, иначе его накопление в поверхностном слое было бы термодинамически невыгодно. Действительно, согласно адсорбционному уравнению Гиббса величина адсорбции положительная, если производная <0. Величина называется поверхностной активностью вещества. ПАВ должны иметь относительно малую растворимость в растворителе, иначе, при хорошей растворимости они стремились бы уйти с поверхности в объем фазы. Таким образом, взаимодействие между молекулами ПАВ и растворителя должно быть меньше взаимодействий между молекулами растворителя. В этом случае молекулы ПАВ будут выталкиваться на поверхность. Накопление на поверхности слабо взаимодействующих веществ приведет к уменьшению межмолекулярного взаимодействия в поверхностном слое и снижению поверхностного натяжения. Характерной особенностью строения молекул ПАВ является их дифильность, т.е. такая молекула должна состоять как бы из двух различных по природе частей – полярной и неполярной групп. Поверхностно-активными веществами относительно воды являются многиеb органические соединения, а именно, жирные кислоты с достаточно большим углеводородным радикалом, соли этих жирных кислот (мыла), сульфокислоты и их соли, спирты, амины. Для строения молекул этих веществ характерно наличие полярной группы и неполярного углеводородного радикала. Обладающая значительным дипольным моментом и хорошо гидратирующаяся полярная группа обусловливает сродство ПАВ к воде. Гидрофобный углеводородный радикал является причиной пониженной растворимости этих соединений. Наименьшее значение поверхностного натяжения водного раствора ПАВ может достигать величин характерных для углеводородов. 18. Термодинамика процесса адсорбции на границе жидкость – газ. Уравнение Шишковского. Физический смысл констант уравнения Шишковского. На рис.22 представлены изотермы адсорбции и поверхностного натяжения для растворов ПАВ в области действия закона Генри (малые концентрации ПАВ). При увеличении концентрации ПАВ закон Генри перестает работать, что следует из вида изотерм адсорбции, приведенных на рис.23. Найдем выражение, описывающее изотермы адсорбции в области более высоких концентраций. Сравнивая процессы адсорбции на границе раздела жидкий раствор/газ и жидкий раствор/твердое тело, можно найти много общих модельных положений. Действительно, как в том, так и в другом случае используется представление о поверхностном растворе, причем в обоих случаях растворенное вещество может появиться в поверхностном слое лишь вытеснив из него молекулу растворителя, т.е процесс адсорбции представляет собой квазихимическую обменную реакцию. Это позволяет для описания процесса адсорбции применить уравнение адсорбции Если выразить мольную долю ПАВ в поверхностном слое через величину адсорбции а и величину адсорбции, соответствующую плотному монослою а∞ , получим Принимая во внимание большую поверхностную активность ПАВ (что отвечает случаю К>>1), установим, что адсорбция ПАВ следует уравнению Ленгмюра Записывая уравнение Ленгмюра (72) через величины концентрации растворенного вещества (15) с учетом соотношения (69), получим Полученное уравнение называется уравнением Шишковского Уравнение изотермы поверхностного натяжения (зависимость ∂=f(c) при Т=const) Б.А. Шишковский получил опытным путем. Первоначально это уравнение имело вид В то время оно скорее устанавливало вид зависимости, но не отвечало на вопрос о физическом смысле входящих в него эмпирических коэффициентов A и в. Ленгмюр, связав свое уравнение с уравнением Гиббса, установил физический смысл констант эмпирического уравнения Шишковского. Из (73) следует, что одна из них определяет предельную адсорбцию и равна является константой равновесия процесса адсорбции в = K. Величину называют предельной адсорбцией. а другая (согласно (67)) 19. Адсорбция на границе раствор – газ. Влияние на адсорбцию на границе раствор – газ строения и размера молекулы поверхностно-активного вещества. Правило Дюкло-Траубе. Молекулы поверхностно-активных веществ обычно дифильны, т. е. имеют полярную и неполярную часть. Полярной частью молекул поверхностно-активного вещества могут быть группы, обладающие достаточно большим дипольным моментом: —СООН; —ОН; —NH2; —SH; — CN; —N02; —NCS; —СНО; —S03H. Неполярной частью молекулы поверхностно-активного вещества обычно являются алифатические или ароматические радикалы. Длина углеводородного радикала сильно сказывается на поверхностной активности молекулы. Дюкло, а затем Траубе, изучая поверхностное натяжение водных растворов гомологического ряда предельных жирных кислот, нашли, что поверхностная активность этих веществ на границе раствор — воздух тем выше, чем больше длина углеводородного радикала, причем в среднем она увеличивается в 3,2 раза на каждую группу СН2. Это легко доказывается тем, что изотермы поверхностного натяжения для гомологического ряда жирных кислот почти полностью совмещаются, если при переходе от одного члена ряда к следующему изменить масштаб значений на оси концентраций в 3,2 раза. Другая формулировка правила Дюкло — Траубе сводится к тому, что когда длина цепи жирной кислоты возрастает в арифметической прогрессии, поверхностная активность увеличивается в геометрической прогрессии. Подобное же отношение должно соблюдаться при удлинении молекулы и для величины 1/А, поскольку поверхностная активность веществ при достаточно малых концентрациях пропорциональна удельной капиллярной постоянной. Причина зависимости, установленной сначала Дюкло, а затем в более общем виде Траубе, заключается в том, что с увеличением длины углеводородной цепи уменьшается растворимость жирной кислоты и тем самым увеличивается стремление ее молекул перейти из объема в поверхностный слой. Например, если масляная кислота смешивается с водой во всех отношениях, то уже валериановая кислота образует только 4%-ный раствор, все же другие кислоты с более высоким молекулярным весом еще менее растворимы в воде. Согласно Леигмюру, правило Дюкло — Траубе можно обосновать следующим образом. Примем, что толщина поверхностного слоя равна б. Тогда средняя концентрация в этом слое будет Г/б. Из термодинамики известно, что максимальная работа А, требующаяся для сжатия газа от объема V1 до объема V2, может быть представлена как Для двух идеальных растворов с концентрацией C1 и с2 соответственно, Тогда работа адсорбции, т е. работа обратимого переноса одного моля растворенного вещества из объема в поверхностный слой, будет равна: Из этого уравнения видно, что работа адсорбции должна увеличиваться на постоянную величину при удлинении углеводородной цепи на группу СН2. Это значит, что при небольших концентрациях, при которых только и соблюдается правило Дюкло — Траубе, все группы СН2 в цепи занимают одинаковое положение по отношению к поверхности, что возможно лишь, когда цепи расположены параллельно поверхности, т. е. лежат на ней. К вопросу об ориентации молекул поверхностно-активного вещества в поверхностном слое мы возвратимся ииже в этом разделе. Правило Дюкло — Траубе соблюдается не только для жирных кислот, но и для других гомологических рядов — спиртов, аминов и т. д. Правило Дюкло — Траубе так, как оно сформулировано выше, выполняется при температурах, близких к комнатной. При более высоких температурах отношение 3,2 уменьшается, стремясь к единице, так как с повышением температуры поверхностная активность снижается в результате десорбции молекул и различие между поверхностной активностью гомологов сглаживается. Следует заметить также, что правило Дюкло — Траубе соблюдается лишь для водных растворов поверхностно-активных веществ. Для растворов этих же веществ в неполярных растворителях правило Дюкло — Траубе обращается, так как с увеличением углеводородной цепи растворимость поверхностно-активного вещества в неполярных жидкостях возрастает и вещество стремится перейти из поверхностного слоя в раствор. 20. Строение адсорбционного слоя на границе раствор – газ. Газообразные и конденсированные поверхностные пленки. Уравнения состояния поверхностных пленок при малых и средних концентрациях ПАВ. Строение адсорбционного слоя на границе раствор – газ. Мономолекулярный слой ПАВ на поверхности жидкости может форми-роваться как в результате адсорбции молекул ПАВ из раствора, так и при нане-сении ПАВ непосредственно на поверхность с дальнейшим его растеканием. До-стижение равновесия в обоих случаях дает один и тот же результат. Мономолекулярные пленки на поверхности воды могут находиться в трех состояниях: газообразном, жидком и твердом . Жидкие и твердые пленки назы-ваются также конденсированными пленками. Агрегатное состояние мономоле-кулярной пленки определяется силами, действующими между молекулами, обра-зующими пленку. Состояние пленки зависит также и от концентрации адсорбирующегося вещества на поверхности. Если концентрация мала и силы взаимодействия меж-ду молекулами незначительны, то молекулы ПАВ движутся по поверхности независимо друг от друга. Такое состояние напоминает поведение газа, поэтому и пленку называют газообразной. В данном случае термин «пленка» является чисто условным, т.к. молекулы на поверхности значительно удалены друг от друга и не образуют сплошного слоя. Свойства газообразных пленок описыва-ются уравнением состояния двухмерного газа. Уравнения состояния поверхностных пленок. Полученные уравнения изотерм поверхностного натяжения для ПАВ = 0 – KгRTc (70) и = 0 -RT ln (1+Kc) (73) позволяют перейти к уравнениям состояния адсорбционных пленок. При малых концентрациях ПАВ в растворе и поверхностном слое соблюдается закон распределения Генри (68), а зависимость поверхностного натяжения от концентрации соответствует соотношению (70). Если в этом соотношении обозначить = - 0 (75) и учесть уравнение (68), то (70) можно записать как = RT(76) Поскольку величина обозначает число молей адсорбированного вещества, приходящегося на единицу поверхности слоя, а обратная ей величина S= 1/ выражает поверхность, на которой распределяется 1 моль адсорбата, то соотношению (76) можно придать вид S = RT (77) Уравнение (77) аналогично уравнению состояния идеального газа. Разница состоит лишь в том, что вместо объема 1 моля газа здесь подразумевают поверхность, занимаемую 1 молем адсорбата, а вместо давления газа – разность поверхностных натяжений, которая получила название давления двухмерного газа. В соответствии с этим уравнение (77) называют уравнением состояния идеального двухмерного газа. При высокой концентрации ПАВ в растворе для описания распределения вещества между объемом и поверхностным слоем следует пользоваться уравнением Ленгмюра (72), а изменение поверхностного натяжения соответствует уравнению Шишковского (73). Представим уравнение (73) в следующем виде: RT RT 1 . 0 ln(1 Kc) После разложения в ряд логарифмической функции получим RT 1 (78) Kc Принимая во внимание уравнение Ленгмюра в линейной форме (74), уравнение (78) можно записать как RT 1 1 (79) Поскольку 1/ = и 1/ = Sm – площадь, занимаемая 1 молем ПАВ в виде двухмерного газа и в состоянии плотного монослоя, то уравнение (79) можно записать как ( -Sm)= RT (80) Уравнение (80) также является уравнением состояния двухмерного газа. В нем учитываются конечные размеры молекул адсорбата и предполагается отсутствие взаимодействия частиц между собой. Это выражение аналогично уравнению Ван-дер-Ваальса с одной постоянной b: P(V-b) = RT. По аналогии с уравнением состояния Ван-дер-Ваальса с двумя константами А.Н. Фрумкин предложил уравнение состояния двухмерного газа, учитывающее взаимодействие молекул ПАВ на поверхности между собой ( - / 2 )( -Sm)= RT , (81) где - постоянная, учитывающая взаимодействие молекул ПАВ в адсорбционном слое. Строение газообразных поверхностных пленок можно представить себе образом. Полярная группа дифильной молекулы ПАВ благодаря гидрофильности и способности гидратироваться будет погружена в воду, а углеводородный радикал будет “плашмя” лежать на воде, т.к. между радикалом и молекулами воды существуют силы притяжения. (Следует подчеркнуть, что выталкивание неполярного радикала на поверхность происходит не за счет сил отталкивания между радикалом и молекулами воды, а потому, что взаимодействия между молекулами воды оказываются предпочтительнее взаимодействий между молекулами воды и радикалом.) Расположение молекул двухмерного газа на поверхности воды схематически показано на рис.25, а. Веществами, образующими на воде газообразные пленки, являются органические дифильные соединения, имеющие небольшой углеводородный радикал, например, жирные кислоты с числом углеродных атомов в цепи, не превышающем двадцати. При увеличении концентрации ПАВ на поверхности и по мере роста тангенциально действующих сил между углеводородными радикалами создаются условия для конденсации пленки. Молекулы ПАВ слипаются и образуют отдельные “островки” плотного монослоя (рои молекул). В таких “островках” тепловое движение молекул сильно затруднено, молекулы ориентируются параллельно друг другу и перпендикулярно поверхности воды, образуя так называемый “частокол Ленгмюра” (рис.25, б). Отдельные молекулы могут отрываться от этих островов и заполнять пространство между ними в виде разреженной газообразной пленки. Такое явление аналогично испарению жидкости или сублимации твердого тела. Веществами, образующими в воде при обычных условиях конденсированные пленки, являются органические соединения с дифильными молекулами, имеющими длинные углеводородные радикалы. Удлинение цепи увеличивает силы взаимодействия между молекулами. Конденсированные пленки обычно жидкие и молекулы в них перемещаются относительно свободно. Вместе с тем, если действующие между радикалами силы взаимодействия возрастают настолько, что делают невозможным перемещение молекул внутри слоя, то такие пленки можно рассматривать как твердые. О наличии у конденсированных пленок свойств твердого тела можно убедиться путем погружения в жидкость (наполовину) маленького стеклянного диска, подвешенного на кварцевой нити к горизонтально вращающейся головке. Если пленка твердая, то при вращении головки образуется некоторый угол закручивания, прежде чем диск, разорвав пленку, последует за головкой. Если же пленка жидкая, образования угла закручивания не происходит - диск следует за закручиваемой головкой. Следует указать, что помимо описанных выше типов пленок существуют еще растянутые пленки (рис.26), промежуточные по свойствам между газообразными и конденсированными пленками. Полагают, что в таких пленках углеводородные цепи молекул не ориентированы параллельно, как в конденсированных пленках, а переплетены между собой или, по крайней мере, энергетически взаимодействуют между собой (слипаются), лежа “плашмя” на воде, подобно молекулам ПАВ в газообразных пленках. Эти взаимодействия препятствуют неограниченному растеканию пленки по поверхности воды. 21. Адсорбция на границе твердое тело – раствор. Молекулярная адсорбция из растворов. Обменная адсорбция. Уравнение молекулярной адсорбции из растворов. Правило Ребиндера. Ионная адсорбция. Лиотропные ряды. Адсорбция из раствора на твердой поверхности наиболее важна для коллоидной химии, так как именно она лежит в основе таких явлений как образование и разрушение коллоидных систем, а также их устойчивости. Адсорбция на границе твердое тело-раствор усложняется наличием третьего компонента - среды (растворителя), молекулы которого могут также адсорбироваться на поверхности адсорбента и являются конкурентами молекул адсорбтива. Таким образом, происходит адсорбция из смеси. Кроме того, адсорбция усложняется взаимодействием молекул адсорбтива с молекулами среды. При адсорбции из раствора на твердом теле принято различать два случая: адсорбция неэлектролитов, когда адсорбируются молекулы адсорбтива, и адсорбцию электролитов, когда избирательно адсорбируется один из ионов электролита. Молекулярная адсорбция из растворов. Адсорбируются молекулы адсорбтива. Количество вещества А, молекулярно адсорбируемое 1 г адсорбента из раствора, вычисляют по уравнению (моль/г): Иногда, когда известна удельная поверхность адсорбента, величину адсорбции относят к единице поверхности (обычно к 1 см2). Зависимость молекулярной равновесной адсорбции из раствора на твердом теле от концентрации адсорбтива характеризуется обычной изотермой адсорбции, и для достаточно разбавленных растворов в этом случае адсорбция хорошо описывается эмпирическим уравнением Фрейндлиха или уравнением Ленгмюра. Конечно, для описания адсорбции из раствора на твердом теле применимо и уравнение Гиббса, но, к сожалению сложность определения поверхностного натяжения на границе твердое тело - раствор не позваляет непосредственно использовать его в этом случае. Если общее число молей вещества в растворе равно n, а мольная доля адсорбтива до адсорбции составляла в растворе N0 и при равновесии с адсорбентом N, то Обменная адсорбция. Если на поверхности адсорбента уже адсорбирован электролит, то при контакте этого сорбента с другим электролитом почти всегда в той или иной степени наблюдается обменная адсорбция, или, правильнее, обмен ионов между двойным электрическим слоем адсорбента и средой. При обменной адсорбции адсорбент, поглощая определенное количество каких-либо ионов, одновременно выделяет в раствор эквивалентное количество других ионов того же знака, вытесненных с поверхности. К обмену способны не только чужеродные ионы с адсорбированными адсорбентами, но и ионы, образующиеся из самого адсорбента в результате диссоциации его молекул. При этом поверхностное явление, каким является адсорбция, может переходить в объемное явление, то есть в обмене могут участвовать ионы, расположенные в глубинных слоях адсорбента, если только к ним возможен доступ раствора. В частности, это происходит при обмене ионов на пермутите натрия и ионообменных смолах. Понятно, что вещества, способные к объемному обмену ионов, обладают особенно высокой емкостью поглощения соответствующего иона из раствора. Обменная адсорбция имеет ряд особенностей. Во-первых, обменная адсорбция специфична, то есть к обмену способны только определенные ионы. Иными словами, на обменную адсорбцию сильно влияет как природа твердой фазы и имеющегося на ней двойного электростатического слоя, так и природа адсорбируемого иона. В зависимости от химической природы ионов, которые могут обмениваться с ионами, содержащиеся в адсорбентах, различают кислотные и основные адсорбенты. Кислотные адсорбенты ведут себя подобно кислоте и способны обменивать с растворами катионами; основные адсорбенты сходны по свойствам с основаниями и обменивают анионы. Впрочем, существует много амфотерных адсорбентов, которые в одних условиях обменивают катионы, а в других - анионы. Специфичность обменной адсорбции указывает на то, что по своей природе этот процесс приближается к химическим явлениям. Во-вторых обменная адсорбция не всегда обратима. В-третьих, обменная адсорбция, как правило, протекает более медленно, чем молекулярная адсорбция. Особенно медленно она протекает, когда происходит обмен ионов, находящихся в глубине адсорбента. Очевидно, в данном случае время необходимо для того, чтобы ионы из раствора продиффундировали в глубь в глубь адсорбента и вытеснили оттуда ионы, которые в свою очередь должны перейти в раствор. В-четвертых, при обменной адсорбции может изменяться рН среды. Это наблюдается в том случае, когда ионом, обмениваемым адсорбентом, является водородный или гидроксильный ион. Если ион заменяет на какой-нибудь катион водородный ион, то последний поступая в раствор, уменьшает рН среды, при это адсорбент ведет себя подобно кислоте. Если адсорбент меняет на какой-нибудь анион гидроксильный ион, то рН раствора. Наоборот, увеличивается, причем адсорбент ведет себя как основание. Наглядно обмен ионов в обоих этих случаях можно изобразить следующими схемами: Б.П. Никольский предложил уравнение, количественно характеризующие обмен ионов 1 и 2 на твердой поверхности: При небольших концентрациях электролита вместо активности а можно пользоваться значением концентрации. В этом случае уравнение связывающие адсорбционную способность ионов 1 и 2 с их концентрацией в растворе, принимает вид: Уравнение молекулярной адсорбции из растворов. Рассмотрим бинарный раствор, состоящий из компонентов 1 и 2 (растворитель и растворенное вещество). Условиями равновесия компонентов на границе раздела т/ж в поверхностном слое и в растворе являются равенства химических потенциалов Величины химических потенциалов компонентов раствора могут быть выражены через величины активностей (a) как С учетом (58) система уравнений (57) может быть записана как В экспоненты этих выражений входят разности химических потенциалов чистых компонентов в поверхностном слое и в объеме. Эти величины характеризуют способность к адсорбции на поверхности твердого тела чистых компонентов. Разделим второе уравнение системы (60) на первое и получим Для краткости записи введем обозначения: Выразим составы поверхностного и объемного бинарных растворов через мольную долю одного из компонентов: Принимая во внимание (62) и (63), уравнение (61) можно записать Уравнение (64) связывает мольную долю компонента 2 в поверхностном слое с его концентрацией в объеме раствора при Т=const. Таким образом, это уравнение является уравнением изотермы адсорбции из бинарных растворов. Правило Ребиндера. Вещество адсорбируется на границе раздела Т-Ж только в том случае, если в результате его присутствия в поверхностном слое разность полярностей фаз уравнивается. Ориентация молекул ПАВ на границе раздела твердое тело – жидкость происходит в соответствии с правилом уравнивания полярностей Ребиндера. Рассмотрим пример, приведенный на рис.27, а. На границе раздела полярного твердого тела, каковым является диоксид кремния, с бензолом (неполярная жидкость) адсорбционный слой молекул ПАВ ориентирован гидрофильной частью к поверхности SiO2, а гидрофобной частью к жидкости. Адсорбционный слой экранирует поверхность адсорбента и сообщает ей неполярные свойства. Таким образом, граница раздела полярное твердое тело – неполярная жидкость в результате адсорбции заменяется на границу раздела неполярная часть адсорбционного слоя – неполярная жидкость. Происходит уравнивание полярностей фаз. Из полярно – неполярной граница раздела становится неполярно – неполярной. Уравнивание полярностей имеет место и во втором случае (рис.27,б), когда неполярная гидрофобная поверхность угля контактирует с полярной жидкостью (водой). Слой молекул ПАВ в данном случае ориентируется противоположным образом. Адсорбция ПАВ на твердой поверхности происходит самопроизвольно и приводит к снижению свободной поверхностной энергии. Одновременно с этим наблюдается снижение прочности твердых тел. Адсорбционное понижение прочности твердого тела было открыто П.А. Ребиндером и по его имени называется эффектом Ребиндера. Автор эффекта обнаружил снижение прочности неорганических кристаллов (гипс, графит, карбонат бария,монокристаллы кальцита и др.) в растворах олеиновой и масляной кислот, пропилового и других органических спиртов, веществ, которые являются ПАВ. В основе адсорбционного понижения прочности лежит фундаментальное уравнение адсорбции Гиббса d = - n d . i i i Снижение поверхностного натяжения на границе раздела означает уменьшение работы, необходимой для образования поверхности раздела фаз. Это, в свою очередь, обусловливает снижение прочности материала и тем самым способствует его разрушению. Разрушение можно рассматривать как процесс образования новой поверхности в трещинах и изломах. Адсорбционное понижение прочности происходит тогда, когда ПАВ адсорбируется на внутренней поверхности твердого тела – трещинах, выемках, дефектах структуры и др. Таким образом, необходимым условием проявления эффекта Ребиндера является наличие трещин и миграция растворов ПАВ к вершине развивающейся трещины. В результате эффекта Ребиндера существенно облегчаются процессы разрушения твердых тел. Этот эффект используют для получения высокодисперсных систем (например, процессы дробления и перемалывания в мукомольной промышленности). Для проявления эффекта Ребиндера необходимы следующие условия 1. Возникновение в теле растягивающих напряжений 2. Наличие ПАВ на поверхности тв. тела 3. Достаточная миграция ПАВ к вершине развивающейся микротрещины Ионная адсорбция. Адсорбция электролитов не укладывается в рамках учения о молекулярной адсорбции и требует специального рассмотрения, поскольку адсорбент может по различному адсорбировать ионы, на которые распадается молекула электролита в растворе. На адсорбции ионов существенным образом сказывается природа адсорбента. Ионы, способные поляризоваться, адсорбируются обычно только на поверхностях, состоящих из полярных молекул или из ионов. Поэтому ионную адсорбцию часто называют также полярной адсорбцией. Микроучастки поверхности, несущие определенный заряд, адсорбируют противоположно заряженные ионы. При этом ионы электролита, несущие противоположный знак, непосредственно не адсорбируются, но под действием сил электростатического притяжения остаются вблизи адсорбированных ионов, образуя с ними на поверхности адсорбента так называемый двойной электрический слой. Радиус ионов сильно влияет на их способность адсорбироваться. Из ионов одинаковой валентности максимальную адсорбционную способность проявляют ионы наибольшего радиуса. Причина этого явления, с одной стороны, заключается в большой поляризуемости таких ионов и, следовательно, их способности притягиваться поверхностью, состоящей из ионов или полярных молекул, с другой стороны, в меньшей гидратации ионов (чем больше радиус иона, тем меньше при одном и том же заряде его гидратация). Гидратация вообще препятствует адсорбции ионов, так как наличие гидратной оболочки уменьшает электрическое взаимодействие. Ряды ионов, составленные в порядке уменьшения их способности связывать среду, называются лиотропными рядами, или рядами Гофмейстера. Одновалентные катионы можно поставить в следующий ряд по возрастающей способности адсорбироваться: Li+ < Na+ < K+ < Rb+ < Cs+ Для двухвалентных катионов это будет следующий ряд: Mg2+ < Ca2+ < Sr2+ < Ba2+ Одновалентные анионы по их возрастающей способности адсорбироваться располагаются в такой последовательности: Cl - < Br - < NO3 - < I - < NCS дсорбционная способность ионов весьма сильно зависит также и от из валентности. Чем больше валентность иона, тем сильнее он притягивается противоположно заряженными микроучастками поверхности. Катионы различной валентности по их возрастающей адсорбционной способности можно расположить в следующий ряд: K+ << Ca2+ << Al3+ << Th4+ Особый интерес для коллоидной химии представляет адсорбция ионов поверхностью кристалла, в состав которого входят ионы той же природы. При этом адсорбцию можно рассматривать как кристаллизацию, то есть как достройку кристаллической решетки способным адсорбироваться ионом. Согласно Панету и Фаяису, кристаллы достраиваются лишь теми ионами или атомами, которые входят в их состав. Например, кристаллы АgI, внесенные в раствор KI, адсорбируют на поверхности иодид-ионы. Если же кристаллы AgI внести раствор AgNO3, то происходит адсорбция ионов серебра. Понятно, что силы, под влиянием которых происходит такая достройка, являются химическими и одновременно электростатическими силами, и ионы, достраивающие кристалл, адсорбируются в этом случае особенно прочно. Существенно, что достраивать кристаллическую решетку способны не только ионы, входящие в состав решетки, но и изоморфные ионы с ними. Важно также, что образовать прочную связь с поверхностью кристалла могут не только ионы, входящие в кристаллическую решетку, но и вообще атомные группы, близкие к атомным группам, находящимся на поверхности. Так, уголь прочно удерживает органические радикалы, а окиси и гидраты окисей алюминия и железа прочно связывают группы содержащие кислород. На поверхности адсорбента могут адсорбироваться как ионы, так и молекулы, из которых они образовались, причем между первыми и последними существует адсорбционное равновесие.