Поверхностные явления. адсорбция
реклама

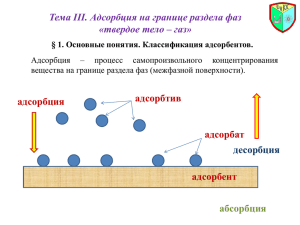
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ Цели и задачи лекции: Поверхностные явления проходят на границе раздела фаз и подчиняются определённым законам и правилам. Рассмотрение этих закономерностей включает в себя изучение поверхностной энергии, поверхностной активности, условий проведения адсорбции, её количественное определение. Расщепление продуктов питания, дыхание, деятельность ферментов, усвоение лекарственных препаратов и другие процессы подчиняются закономерностям адсорбции. Изучение этих закономерностей и является целью данной лекции. Основные понятия и определения Раздел химии, изучающий дисперсное состояние вещества и поверхностные явления называется коллоидной химией. Размеры частиц дисперсной системы и обратная им величина называется дисперсностью системы. Отношение площади поверхности S к единице массы m или объёма V вещества называется удельной поверхностью: S S So= --------- cм2 /г ; So= --------- cм2/мл m V Основные понятия и определения Поверхностные явления – это явления, проходящие на границе раздела фаз или проходящие в результате воздействия фаз. Отношение поверхностной энергии к единице поверхности называется поверхностным натяжением. G = -------- ; Дж /cм2 G= S ; Дж S G – пов.энергия ; - коэф. пов-го.натяжения Процессы сорбции Изменение концентрации вещества на границе раздела фаз называется адсорбцией. Поглащающее вещество называется адсорбентом Поглощаемое вещество называется адсорбтивом Адсорбция газов называется абсорбцией Адсорбция, сопровождаемая взаимодействием адсорбента и адсорбтива называется хемосорбцией Процесс обратный сорбции называется десорбцией Поверхности на которых проходит адсорбция Газ – жидкость. Газ – твёрдое вещество Жидкость – жидкость. Жидкость – твёрдое вещество В организме человека: Клетки и ядра клеток, протоплазма, граница раздела между организмом и окружающей средой. Процессы, проходящие на границах раздела: дыхание, обмен жиров, пищеварение, деятельность ферментов, биосинтез белков и др. Факторы, влияющие на адсорбцию на неподвижной поверхности 1. Природа адсорбента и адсорбтива 2. Степень дисперсности адсорбента 3. Концентрация растворённого вещества или давление для газов 4. Температура 5. Природа растворителя Изучение количества адсорбции Удельная адсорбция–это отношение числа молей адсорбированного в-ва на единицу величины поверхности 1 cм2 или массы 1 г адсорбента X Г= ------- моль/cм2 S X ; Г = ------- моль/г m Уравнение Фрейндлиха для неподв.пов-и X Г = ------- = K·C1/n m X Г = ------- = K ·P1/n m Изучение количества адсорбции Уравнение прямой Фрейндлиха: X lg ------- = lgK +1/n lgC lg x/m m ) tg = 1/n lg K lg C Изотерма адсорбции Изучение количества адсорбции Уравнение Ленгмюра для монослойной адсорбции на неподвижной поверхности: bC Г = Г ----------1+ bC Г - величина адсорбции Г - максим-ая адсорбция C – кoнцентр. вещества Для низких концентраций вещества: Г = Г · bC Для высоких концентраций вещества: Г = Г Изучение количества адсорбции Изотерма адсорбции Ленгмюра Г I II III С Поверхностное натяжение и поверхностная активность Вещества, понижающие поверхностное натяжение жидкости называются поверхностно-активными веществами. Это жиры, масла, спирты и другие органические вещества. Вещества, повышающие поверхностное натяжение жидкости наз-ся пов.-инактивными веществами – это соли, др. электролиты. Изменение пов. натяжения с изменением конц-ции вещества наз-ся поверхностной активностью: d / dC Изучение количества адсорбции Уравнение Гиббса для неподвижной пов-ти: C d C –концен-я вещества Г = - ------- · ---------- R – универ. газ. постоянная RT dC T – абс-я температура d ---------- < 0 - адсорбция положительная dC d ---------- > 0 -адсорбция отрицательная dC Правило Дюкло-Траубе Вещества содержащие и гидрофильные и гидрофобные группы называются дифильными. Правило Дюкло-Траубе: Удлинение углеводородного радикала дифильных органических молекул на каждую - CH2 - группировку, увеличивает способность этого соединения к адсорбции в 2-3 раза.