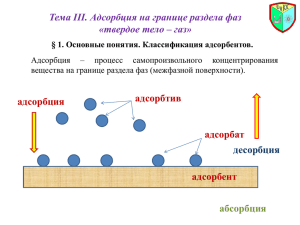
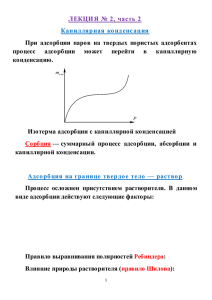
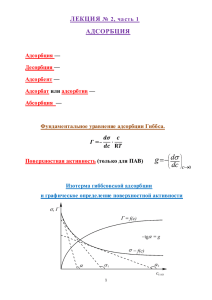
При физической адсорбции, как правило, очень быстро
реклама

При физической адсорбции, как правило, очень быстро устанавливается равновесие между адсорбированными частицами, находящимися в газовой фазе, т. е. равенство скоростей адсорбции и обратного ей процесса десорбции. Считают, что физическая адсорбция вызывается теми же неспецифическими силами межмолекулярного взаимодействия, что и конденсация паров. Теплота физической адсорбции невелика; она близка к теплоте конденсации и составляет обычно 10–40 кДж/моль. Как правило, физическая адсорбция играет существенную роль при понижении температуры газа ниже критической, т. е. когда газ находится в виде пара. Хемосорбция может протекать при температуре и выше, и ниже критической температуры адсорбента. От физической адсорбции ее отличает, прежде всего, значительно большая специфичность, т. е. зависимость от химической природы адсорбента и адсорбата. Значения теплоты хемосорбции близки к значениям теплоты химических реакций. Хемосорбированные вещества удалить с поверхности адсорбента значительно труднее, чем при физической адсорбции, причем десорбция может сопровождаться химическими реакциями. Например, при термической десорбции кислорода с угля (кислород хемосорбируется на угле очень прочно) вместо кислорода выделяется смесь СО и СО2. Хемосорбция нередко протекает сравнительно медленно, со скоростью, определяемой наличием активационного барьера (отсюда название «активированная адсорбция»). Процесс хемосорбции может состоять из двух стадий: сначала происходит быстрая физическая адсорбция газа, а затем он вступает в медленную химическую реакцию с поверхностью твердого тела. При низких температурах скорость хемосорбции так мала, что практически наблюдается только физическая адсорбция. Наоборот, при высоких температурах физическая адсорбция почти незаметна и происходит лишь хемосорбция. Скорость гетерогенно-каталитических реакций пропорциональна поверхностным концентрациям адсорбированных молекул. Так как на практике часто можно считать, что на поверхности катализатора имеет место адсорбционнодесорбционное равновесие, о поверхностных концентрациях реагентов можно судить по равновесному распределению молекул адсорбата между поверхностью твердого тела и газовой фазой. Это распределение зависит от давления, температуры, природы адсорбента и адсорбата, от площади адсорбента. Принято оценивать равновесное распределение по изотермам адсорбции, показывающим, как количество адсорбированного вещества зависит от равновесного парциального давления данного газа при постоянной температуре. Существует несколько видов изотерм адсорбции. Рассмотрим вывод изотермы адсорбции Ленгмюра. В основе этого вывода лежит несколько допущений, учет которых приводит к более сложным уравнениям. Допущения эти таковы: – адсорбированные частицы связаны с определенными локализованными центрами на поверхности адсорбента; 46