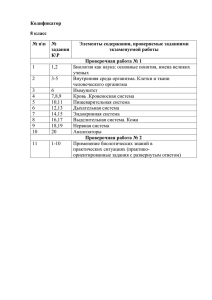
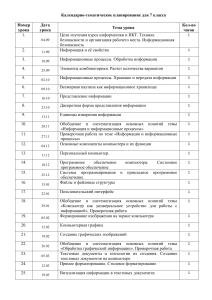
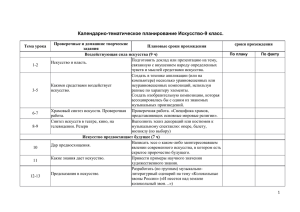
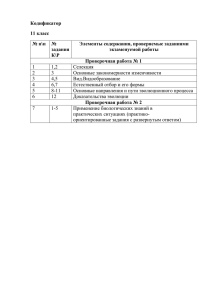
Проверочные работы по химии Каждая проверочная работа содержит 4 варианта разного уровня сложности: варианты I и II содержат более простые задания, варианты III и IV предназначены для учащихся наиболее подготовленных. Работы рассчитаны на 20 – 25 минут урока и могут быть проведены как в полном объеме, так и выборочно, с использованием отдельных заданий. Темы проверочных работ к учебнику О.С. Габриеляна «Химия – 8» 1. Введение. Первоначальные химические понятия. 2. Атомы химических элементов. 3. Простые вещества. Количественные соотношения в химии. 4. Степень окисления. Составление формул соединений. 5. Соединения химических элементов. 6. Вычисление массовой (объемной) доли компонентов смеси (раствора). 7. Изменения, происходящие с веществами. 8. Расчеты по химическим уравнениям. 9. Теория электролитической диссоциации. 10. Реакции ионного обмена. 11. Окислительно – восстановительные реакции. 8 класс Проверочная работа по теме: «Введение. Первоначальные химические понятия». Вариант I 1. Установите соответствие. Символ элемента: 1. Nа. 2. С. 3. К. Название элемента: А. Натрий. Б. Железо. Д. Углерод. Е. Кальций. 4. Fе. В. Калий. 5. Zn. Г. Цинк. 2. Рассчитайте относительные молекулярные массы веществ, формулы которых ВаО, SО2. 3. Используя химическую символику (знаки химических элементов, индексы, коэффициенты), запишите: А. Три молекулы кислорода, каждая из которых состоит из двух атомов кислорода. Б. Четыре атома водорода. 4. Запишите знак химического элемента второго периода главной подгруппы IV группы Периодической таблицы. 8 класс Проверочная работа по теме: «Введение. Первоначальные химические понятия». Вариант II 1. Установите соответствие. Символ элемента: 1. S. 2. Са. 3. Р. 4. Сu. 5. N. Название элемента: А.Кальций. Б. Пэ. В. Эс. Г. Эн. Д. Купрум. Е. Калий. 2. Рассчитайте относительные молекулярные массы веществ, формулы которых СаО, СuСI2. 3. Используя химическую символику (знаки химических элементов, индексы, коэффициенты), запишите: А. Две молекулы азота, каждая из которых состоит из двух атомов азота. Б. Три атома углерода. 4. Запишите знак химического элемента третьего периода главной подгруппы II группы Периодической таблицы. 8 класс Проверочная работа по теме: «Введение. Первоначальные химические понятия». Вариант III 1.Из данного перечня выберите элементы-металлы и запишите их с помощью химических знаков: водород, магний, сера, кальций, натрий. 2. Сравните относительные молекулярные массы веществ, формулы которых Fе2O3, НNO3. 3. Объясните, что обозначают следующие записи 2СО2, 3Р4. 4. Укажите положение химических элементов серы и фтора в Периодической таблице Д.И. Менделеева. 8 класс Проверочная работа по теме: «Введение. Первоначальные химические понятия». Вариант IV 1.Из данного перечня выберите элементы-металлы и запишите их с помощью химических знаков: цинк, кремний, углерод, сера, железо. 2. Сравните относительные молекулярные массы веществ, формулы которых H3PO4, Н2SO4. 3. Сравните (укажите общее и различное) для записей: 6H и 3Н2. 4. Сравните положение в Периодической таблице Д.И. Менделеева элементов лития и натрия. 8 класс Проверочная работа по теме: «Атомы химических элементов». Вариант I 1. Выберите химические элементы-металлы и запишите их символы: фосфор, кальций, бор, литий, магний, азот. 2. Определите химический элемент с электронной схемой атома +7 ) ). 2 5 3. Определите тип связи в веществах: хлориде натрия NаСI, водороде Н2, хлороводороде НСI. 4.Составьте схему образования связи для одного из веществ, указанных в задании 3. 8 класс Проверочная работа по теме: «Атомы химических элементов». Вариант II 1. Выберите химические элементы-неметаллы и запишите их символы: натрий, водород, сера, кислород, алюминий, углерод. 2. Запишите схему электронного строения атома углерода. 3. Определите тип связи в веществах: фториде натрия NаF, хлоре Cl2, фтороводороде НF. 4.Составьте схему образования связи для двух из указанных в задании 3 веществ. 8 класс Проверочная работа по теме: «Атомы химических элементов». Вариант III 1. Расположите знаки химических элементов: Вг, Р, I, Сl в порядке увеличения неметаллических свойств. Ответ поясните. 2. Дополните схему электронного строения атома +13 ) ) ). Определите химический элемент, ? ? 3 число протонов и нейтронов в ядре его атома. 3. Определите типы химической связи и запишите их образования для веществ: хлорида магния МgСl2, фтора F2, сероводорода Н2S. 8 класс Проверочная работа по теме: «Атомы химических элементов». Вариант IV 1. Расположите знаки химических элементов: Li, K, Na, Mg в порядке увеличения металлических свойств. Ответ поясните. 2. По неполной электронной схеме атома +9 ) ). Определите химический элемент, число 27 протонов и нейтронов в его ядре. 3. Определите типы химической связи и запишите схемы их образования для веществ: хлорида кальция CaСl2, азота N2, воды Н2O. 8 класс Проверочная работа по теме: «Простые вещества. Количественные соотношения в химии». Вариант I 1. Чему равно количество вещества кислорода O2 массой 6,4 г? 2. Рассчитайте: а) массу; б) объем газа водорода Н2 количеством вещества 0,2 моль. 3. Перечислите общие физические свойства металлов. 8 класс Проверочная работа по теме: «Простые вещества. Количественные соотношения в химии». Вариант II 1. Рассчитайте количество вещества водорода Н2 массой 0,4 г. 2. Рассчитайте: а) массу; б) объем газа озона О3 количеством вещества 0,3 моль. 3. Перечислите общие физические свойства неметаллов. 8 класс Проверочная работа по теме: «Простые вещества. Количественные соотношения в химии». Вариант III 1. Рассчитайте массу, объем и количество вещества углекислого газа СО2, содержащего 9 . 1023 молекул. 2. Сравните кислород и озон. 3. Назовите причины аллотропии химических элементов. . 8 класс Проверочная работа по теме: «Простые вещества. Количественные соотношения в химии». Вариант IV 1. Рассчитайте массу, число молекул и количество вещества сероводорода Н2S объемом 5,6 л (н. у.). 2. В чем сходство и различие красного фосфора и белого фосфора? 3. Докажите относительность деления простых веществ на металлы и неметаллы 8 класс Проверочная работа по теме: «Степень окисления. Составление формул соединений». Вариант I 1. Определите степени окисления атомов элементов в соединениях, формулы которых SiO2, Nа2О, К2S, LiВг. 2. Какая из следующих формул соответствует оксиду азота (II): NО, N2О5, NО2, N2О? 3. Напишите формулы веществ: а) оксида серы (IV) б) оксида серы (VI). 8 класс Проверочная работа по теме: «Степень окисления. Составление формул соединений». Вариант II 1. Определите степени окисления атомов химических элементов в соединениях, формулы которых Н2O, АlСl3, N2О5, Nа3Р. 2. Выберите формулу оксида марганца (IV): МnО, Мn2O7, МnF4, МnО2. 3. Напишите формулы веществ: а) оксида цинка; б) оксида натрия. 8 класс Проверочная работа по теме: «Степень окисления. Составление формул соединений». Вариант III 1. Выберите формулы химических соединений, в которых марганец проявляет степень окисления +4: МnО2, МnF2, МnО, МnСl4, Мn2O7. 2. Какие из приведенных названий соответствуют формуле СО2: оксид углерода (II), углекислый газ, угарный газ, оксид углерода (IV)? 3. Напишите формулы веществ: а) нитрида натрия; б) сульфида алюминия. 8 класс Проверочная работа по теме: «Степень окисления. Составление формул соединений». Вариант IV 1. Выпишите формулы химических соединений, в которых водород проявляет степень окисления, равную -1: Н2S, СаН2, LiН, NН3, НСI, AlH3. 2. Выберите формулу сульфида железа (II) из перечисленных: FеО, FеS2, Fе2S, FеS. 3. Напишите формулы веществ: а) хлорида кальция; б) хлорида железа (III). 8 класс Проверочная работа по теме: «Соединения химических элементов». Вариант I 1. Выберите формулы оксидов, дайте их названия: NаОН, МgО, НNO3, Р2O5. 2. Выберите формулу одноосновной кислородсодержащей кислоты, назовите ее: НСI, Н3РO4, НNО3, Н2SO4. 3. Составьте формулы соединений: сульфата бария, нитрата алюминия, гидроксида магния, хлорида кальция. 8 класс Проверочная работа по теме: «Соединения химических элементов». Вариант II 1. Выберите формулы оснований, дайте их названия: СаСО3, КОН, Nа2О, Са(ОН)2. 2. Выберите формулу двухосновной бескислородной кислоты, назовите ее: НF, Н2S, Н3РO4, H2SO4. 3. Составьте формулы соединений: нитрата серебра, гидроксида алюминия, сульфата калия, хлорида железа (III). 8 класс Проверочная работа по теме: «Соединения химических элементов». Вариант III 1. Составьте формулы оксидов, соответствующих гидроксидам: а) NаОН; б) Fе(ОН)3. Дайте названия всех веществ. 2. Выберите формулу кислоты, в которой степень окисления атома серы равна +6: Н2SO3, Н2S, Н2SO4, Н2S2O4. 3. Составьте формулы солей, образованных ионами, и дайте их названия. Ионы ClSO42PO43- Na+ Al3+ 8 класс Проверочная работа по теме: «Соединения химических элементов». Вариант IV 1. Составьте формулы оксидов, соответствующих кислотам: а) Н2SО4 б) Н3РO4. Дайте названия всех веществ. 2. Выберите формулу кислоты, в которой степень окисления атома, дающего название кислоте, равна +5: Н2SiO3, НNO3, Н2СO3, НСl. 3. Составьте формулы солей, образованных нонами, и дайте их названия. Ионы NO3PO43CO32- K+ Ca2+ 8 класс Проверочная работа по теме: «Вычисление массовой (объемной) доли компонентов смеси (раствора)». Вариант I 1. В 180 г воды растворили 20 г соли. Определите массовую долю соли в растворе. 2. Рассчитайте объем кислорода, содержащегося в воздухе объемом 500 л (объемную долю кислорода в воздухе примите за 21%). 8 класс Проверочная работа по теме: «Вычисление массовой (объемной) доли компонентов смеси (раствора)». Вариант II 1. В 18 г воды растворили 7 г вещества. Определите массовую долю вещества в растворе. 2. Рассчитайте объем азота, содержащегося в 40 л воздуха (объемную долю азота в воздухе примите за 78%). 8 класс Проверочная работа по теме: «Вычисление массовой (объемной) доли компонентов смеси (раствора)». Вариант III 1. Рассчитайте массы воды и соли, необходимые для приготовления 50 г раствора с массовой долей соли в растворе 10%. 2. К 80 л воздуха добавили 20 л кислорода. Определите объемные доли кислорода и азота в полученной смеси. 8 класс Проверочная работа по теме: «Вычисление массовой (объемной) доли компонентов смеси (раствора)». Вариант IV 1. Определите массу раствора, в котором содержится 87,5 г соли, массовая доля которой в растворе равна 0,25. 2. Воздух объемом 160 л смешали с кислородом количеством вещества 0,5 моль. Определите объем (н. у.) и количество вещества кислорода в полученной смеси. 8 класс Проверочная работа по теме: «Изменения, происходящие с веществами». Вариант I 1. Приведите два примера физических явлений. 2. Какими приборами или химической посудой вы воспользуетесь, чтобы отделить подсолнечное масло от воды наиболее простым способом: а) выпаривательной чашкой; б) воронкой с фильтром; в) делительной воронкой; г) прибором для дистилляции? 3. Расставьте коэффициенты в схемах химических реакций, укажите их тип: а) Сu + O2 СuО; в) Zn + НCl ZnСl2 + Н2; б) СаСО3 СаО + СО2; г) СuО + НСl СuСl2 + Н2O. 8 класс Проверочная работа по теме: «Изменения, происходящие с веществами». Вариант II 1. Приведите два примера химических явлений. 2. В сахар попал речной песок. Как получить чистый сахар? Выберите способы разделения смеси, запишите их в нужной последовательности: возгонка, выпаривание, отстаивание, дистилляция, фильтрование, растворение в воде. 3. Расставьте коэффициенты в приведенных ниже схемах химических реакций, укажите их типы: а) Сu(OH)2 Сu + H2О; в) KBr + Cl2 KСl + Br2; б) HCl + Nа2О NaСl + H2O; г) Zn + O2 ZnO. 8 класс Проверочная работа по теме: «Изменения, происходящие с веществами». Вариант III 1. Как в походных условиях очистить и обеззаразить (сделать пригодной для питья) воду из природного источника? Предложите свой план действий. 2. Из перечисленных ниже явлений выберите физические явления: плавление парафина, прокаливание медной проволоки, горение бензина, выпаривание поваренной соли, ржавление железа, испарение воды. 3. Запишите уравнения химических реакций по названиям исходных веществ и продуктов реакции: а) азотная кислота + гидроксид калия нитрат калия + вода; б) оксид натрия + вода гидроксид натрия. Укажите типы всех реакций. 8 класс Проверочная работа по теме: «Изменения, происходящие с веществами». Вариант IV 1. Запишите, какие различия в свойствах веществ лежат в основе способов разделения смесей: а) дистилляции; в) отстаивании; б) фильтровании; г) выпаривании. 2. Из перечисленных ниже явлений выберите химические явления: превращение воды в лед, горение парафиновой свечи, скисание молока, плавление свинца, пропускание углекислого газа через известковую воду, пропускание кислорода через дистиллированную воду. 3. Запишите уравнения химических реакций по названиям исходных веществ и продуктов реакции: а) фосфорная кислота + гидроксид натрия фосфат натрия + вода; б) алюминий + соляная кислота Укажите типы всех реакций. хлорид алюминия + водород. 8 класс Проверочная работа по теме: «Расчеты по химическим уравнениям». Вариант I 1. Рассчитайте объем водорода (н. у.), полученного при взаимодействии цинка массой 13 г с избытком соляной кислоты. Уравнение химической реакции: Zn + 2НСl = ZnС12 + Н2. 2. Рассчитайте массу оксида меди (II), полученного при разложении гидроксида меди (II) количеством вещества 0,4 моль. Уравнение химической реакции: Сu(ОН)2 = СuО + Н2O. 8 класс Проверочная работа по теме: «Расчеты по химическим уравнениям». Вариант II 1. Рассчитайте массу магния, который может сгореть в кислороде объемом 33,6 л (н. у.). Уравнение химической реакции: 2Мg + O2 = 2МgO. 2. Рассчитайте массу воды, полученной при сгорании в кислороде водорода количеством вещества 0,6 моль. Уравнение химической реакции: 2Н2 + O2 = 2Н2O. 8 класс Проверочная работа по теме: «Расчеты по химическим уравнениям». Вариант III 1. Рассчитайте массу и количество вещества соли, полученной при взаимодействии серной кислоты массой 58,8 г с избытком гидроксида меди (II). Уравнение химической реакции: Сu(ОН)2 + Н2SO4 = СuSO4 + 2Н2О. 2. Технический цинк массой 7 г, содержащий 7% примесей, растворили в избытке соляной кислоты. Рассчитайте: а) объем выделившегося водорода (н. у.); б) количество вещества водорода. 8 класс Проверочная работа по теме: «Расчеты по химическим уравнениям». Вариант IV 1. Рассчитайте массу и количество вещества фосфора, необходимого для реакции с кислородом объемом 56 л (н. у.). 2. Рассчитайте массу и количество вещества соли, полученной при взаимодействии 200 г 24,5%-ного раствора серной кислоты с избытком оксида меди (II). 8 класс Проверочная работа по теме: «Теория электролитической диссоциации». Вариант I 1. Из приведенного перечня веществ выпишите формулы веществ, которые практически диссоциируют: КСI, РbS, Ва(ОН)2, СаСО3, СuО, Н2SO4, Fе(0Н)2. 2. Запишите уравнения электролитической диссоциации веществ: а) хлорида натрия; б) нитрата калия; в) хлорида алюминия. Укажите названия всех ионов. 3. Что общего в диссоциации всех кислот? Приведите не менее двух примеров уравнений электролитической диссоциации кислот. 8 класс Проверочная работа по теме: «Теория электролитической диссоциации». Вариант II 1. Из данного перечня веществ выпишите формулы веществ, которые практически не диссоциируют: МgС12, ВаSO4, КОН, Fе2O3, НNO3, Zn(OН)2, Nа3РO4. 2. Запишите уравнения электролитической диссоциации веществ: а) хлорида калия; б) гидроксида натрия; в) нитрата магния. Укажите названия всех ионов. 3. Что общего в диссоциации оснований? Все ли основания практически диссоциируют на ионы? Приведите примеры уравнений электролитической диссоциации оснований. 8 класс Проверочная работа по теме: «Теория электролитической диссоциации». Вариант III 1. Вам выдали твердое кристаллическое вещество. Как определить, является оно электролитом или нет? Составьте краткий план ваших практических действий. 2. В склянке с раствором неизвестного вещества были обнаружены катионы магния и нитрат анионы. Какое вещество могли взять для приготовления данного раствора? Составьте уравнение электролитической диссоциации этого вещества. 3. Что общего в диссоциации кислот и солей? Ответ подтвердите уравнениями электролитической диссоциации. 8 класс Проверочная работа по теме: «Теория электролитической диссоциации». Вариант IV 1. Вещество Х хорошо растворимо в воде. Можно ли на основании этого утверждать, что вещество Х является электролитом? Ответ мотивируйте. 2. Имеются твердые вещества: сульфат железа (II), гидроксид железа (II), сульфат железа (III), гидроксид железа (III). Какое из этих веществ можно взять для приготовления раствора, который будет содержать ионы Fе3+? Запишите уравнение электролитической диссоциации этого вещества. 3. В склянке с раствором неизвестного вещества обнаружены катионы натрия. Можно ли однозначно утверждать, что в растворе находится соль натрия? Ответ обоснуйте. 8 класс Проверочная работа по теме: «Реакции ионного обмена». Вариант I 1. Закончите молекулярные уравнения химических реакций, составьте для них ионные уравнения: а) КОН + СuSO4 ...; б) Ва(ОН)2 + НNО3 …. 2. Какие пары ионов могут одновременно находиться в растворе: а) Сu2+ и ОН-; б) Zn2+ и Сl-; в) Аg+ и Сl-? Ответ мотивируйте. 8 класс Проверочная работа по теме: «Реакции ионного обмена». Вариант II 1. Закончите молекулярные уравнения химических реакций, составьте для них ионные уравнения: а) АgNО3 + ВаСl2 ...; б) H2SO4 + КОН ... . 2. Какие из веществ будут реагировать друг с другом: а) FеSО4 и КОН; б) КNO3 и NаОН? Ответ подтвердите уравнениями реакций в молекулярном и ионном виде. 8 класс Проверочная работа по теме: «Реакции ионного обмена». Вариант III 1. Взаимодействие каких веществ друг с другом отражает ионное уравнение Сu2+ + 2ОН- = Сu(ОН)2: а) СuСl2 и Zn(ОН)2; б) СuО и NаОН; в) Сu(NО3)2 и Ва(ОН)2? Ответ подтвердите составлением молекулярного и ионного уравнений. 2. В колбе имеется раствор, содержащий ионы: Na+, Ва2+, NO3-, ОН-. Какие вещества могли взять для приготовления данного раствора? Запишите формулы и названия возможных веществ. Может ли ответ быть однозначным? Поясните. 8 класс Проверочная работа по теме: «Реакции ионного обмена». Вариант IV 1. Приведите не менее двух уравнений реакций в молекулярном виде, соответствующих ионному уравнению: Сu(ОН)2 + 2Н+ = Сu2+ + 2Н2O. 2. В трех пронумерованных колбах имеются растворы, содержащие карбонат натрия, хлорид натрия и серную кислоту. Можно ли распознать, в какой колбе какое вещество находится, не используя никаких других веществ? Составьте план распознавания и запишите уравнения соответствующих реакций в молекулярном и ионном виде. 8 класс Проверочная работа по теме: «Окислительно – восстановительные реакции». Вариант I 1. Расставьте степени окисления атомов элементов в соединениях, формулы которых: SO2, SO3, CS2, МgS. 2. По схеме окислительно-восстановительной реакции: Nа + Сl2 NаСl определите окислитель и восстановитель, составьте электронный баланс, укажите процессы окисления и восстановления. _ 0 +3 3. Схема А1 — 3е Al отражает процесс: а) окисления; б) восстановления; в) и окисления, и восстановления. 8 класс Проверочная работа по теме: «Окислительно – восстановительные реакции». Вариант II 1. Расставьте степени окисления атомов элементов в соединениях, формулы которых: РСl3, Р2O5, Са3Р2, Nа3Р. 2. По схеме окислительно-восстановительной реакции K+S К2S определите окислитель и восстановитель, составьте электронный баланс, укажите процессы окисления и восстановления. _ 3. Схема Р + 3e восстановления. 0 -3 Р отражает процесс: а) окисления; б) восстановления; в) и окисления, и 8 класс Проверочная работа по теме: «Окислительно – восстановительные реакции». Вариант III 1. Выберите формулы соединений, в которых сера проявляет степень окисления -2: SO2, SF6, СаS, SiS2, SО3. 2. Из приведенных схем выберите схему окислительно-восстановительной реакции и рассмотрите ее с позиций окисления-восстановления (составьте электронный баланс, укажите процессы окисления и восстановления, определите окислитель и восстановитель): а) СаО + СО2 СаСО3; б) Fе + СuSO4 Сu + FеSО4; в) FеСl3 + АgNO3 АgСl + Fе(NO3)3. 3. Расставьте коэффициенты в схеме окислительно-восстановительной реакции А1+С12 АlСl3 методом электронного баланса. Укажите окислитель и восстановитель. 8 класс Проверочная работа по теме: «Окислительно – восстановительные реакции». Вариант IV 1. Выберите формулы соединений, в которых азот проявляет степень окисления -3: N2O3, Mg3N2, NО2, NН3, КNO3. 2. Из приведенных схем выберите схему окислительно-восстановительной реакции и рассмотрите ее с позиций окисления-восстановления (составьте электронный баланс, укажите процессы окисления и восстановления, определите окислитель и восстановитель): а) NаС1 + АgNО3 NаNО3 + АgCl; б) А1 + S в) Сu(ОН)2 А12S3; СuО + Н2O. 3. Расставьте коэффициенты в схеме окислительно-восстановительной реакции А1 + СuСl2 Сu + АlСl3 методом электронного баланса. Укажите окислитель и восстановитель.