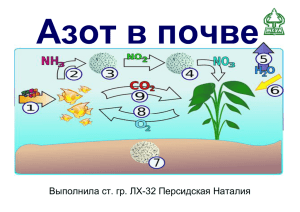
ЛЕКЦИЯ. Удобрения, их свойства и применение Классификация удобрений: - органические удобрения - по химическому составу - минеральные удобрения - бактериальные препараты - по способу производства - по - по составу и концентрации физическому состоянию - местные – навоз и его разновидности, торф, зола, фекалии, зеленые удобрения, отходы коммунального хозяйства городов и других населенных пунктов, бактериальные удобрения; - промышленные – азотные, фосфорные, калийные, комплексные удобрения, микроудобрения, бактериальные препараты; - простые – азотные, фосфорные, калийные, содержащие 70-80% балласта и один питательный элемент, микроудобрения; - комплексные – содержащие в своем составе два и больше питательных вещества, физиологически активных веществ – бесбалластные; -твердые - аморфные, кристаллические (мелко- или крупно-), гранулированные (мелко- или крупно-); - жидкие - растворы, суспензии. ПИТАНИЕ РАСТЕНИЙ Азот входит в состав всех простых и сложных белков, нуклеиновых кислот (РНК и ДНК). Содержится в хлорофилле, фосфатидах, алкалоидах, ферментах и в других органических веществах клетки. Главным источником азота для растений является нитратный (NO3-) и аммиачный(NН4+) азот, кроме того, ряд растений способна поглощать молекулярный азот (N2), нитратную форму (NO2-), аминоформу (NН2) и азот, входящий в состав многочисленных органических соединений. Азот, поступивший в растения в минеральных формах, проходит сложный цикл превращений, конечным итогом которых является включение в его состав белковых молекул. Основа лежит в реакции аминирования взаимодействие аммиака и с группой соответствующих кислот (дикарбоновых). Принято считать, что все доступные формы азота в начале превращаются в растении в аммоний - NO3 →NO2→ NH4 . Так, щавелевоуксусная кислота, присоединяя аммиак и отщепляя воду, образует иминощавелевоуксусную кислоту, которая затем восстанавливается до аспарагиновой: +NH3 -H2O COOH·CO·CH2·COOH→COH·C=NH4·CH2·COOH+2H→COOH·CH2·CHNH2·COOH реакция образования первичных аминокислот (аспарагиновая и глютаминовая) играет большую роль в метаболизме растительного организма. ФОРМЫ АЗОТА Исследованиями Д.Н. Прянишникова и его учеников показано, что аммиачный и нитратный азот при определенном сочетании внешних и внутренних условий могут быть равноценными источниками азота для растения. Однако при некоторых условиях лучшим источником азота может быть NH4+, а при других условиях- NO3- . Поглощение NH4+ способствует: нейтральная реакция почвенного раствора, увеличение концентрации Са, Мg и К, содержание в растениях углеводов, температура почвы 5-10 ºС, 1020ºC и 20-30ºC. Поглощению NO3- способствует: кислая реакция рН, достаточное содержание Р и Мо, температура почвы10-20 ºC, 2025ºC и 30-35ºC. Превращение азота в почве. Белки, гуминовые вещества→ аминокислоты, амиды→ аммиак→ нитриты→ нитраты→ газообразные формы азота Распад азотистых органических веществ почвы до аммиака называется аммонификацией. Осуществляется обширными группами аэробных микроорганизмов: бактерии, плесневые грибы. и анаэробных В результате процессов дезаминирования от этих соединений отщепляется NH3 и образуются органические кислоты, которые дальше разлагаются до простейших соединений Н2О, СО2, Н2, СН4. Выделяющийся NH3 образуют соли с органическими и минеральными кислотами: 2NH3+H2CO3=(NH4)2CO3 Са (ППК) + (NH4)2 CO3 = (ППК) NH4 + СаСО3 Са Окисление аммиака до нитратов называется нитрификацией. Осуществляется группой специфических бактерий, для которых это окисление является источником энергии. Идет в две фазы. В окислении аммиачных солей до азотистой кислоты принимают бактерии рода Нитрозамонас и Нитрососпира, а до азотной кислоты бактерии рода Нитробактер. Может идти по следующему уравнению: 2NH3+3O2=2HNO2+2H2O 2HNO2+O2=2HNO3 Нитрификация является многоэтапным процессом NH3→NH4OH→NH2OH→ через ряд промежуточных продуктов →HNO2→HNO3 Образовавшаяся при нитрификации HNO3 кислота нейтрализуется бикарбонатом кальция, магния или основаниями почвы: 2HNO3+Ca(HCO3)2=Ca(NO3)2+2H2CO3 Са Са HNO3+(ППК)=(ППК)H+Ca(NO3)2 Са Н Оптимальными условиями для нитрификации являются: аэрация, влажность 60-70 % от капиллярной влагоемкости, температура 25-32 ºC, рН 6,5-7,5. В год может образовываться до 100 мг NO3 на 1 мг почвы. На скорость образования нитратов влияют: обработка почвы, удобрения, мелиорация. Денитрификация - процесс восстановления нитратного азота до газообразных форм (NO, N2O, N2). Осуществляется обширной группой бактерий, носящих название денитрификаторов. Этот процесс особенно интенсивно развивается в условиях, когда в почве отсутствует воздух, почва имеет щелочную реакцию и в избытке органической вещество богатое клетчаткой, глюкозой и другими углеводами. Восстановление нитратов до нитритов осуществляется при участии ферментов – нитратредуктазы, а дальнейшее восстановление нитритов – с помощью нитритредуктазы. C6H12O6+6HNO3→CO2+9H2+3N2O 5C6H12O6+24HNO3→30CO2+42H2O+12N2 Восстановление нитратов идет через ряд промежуточных этапов HNO3→HNO2→(HNO)2→N2O→N2 Существует тесная связь между денитрификацией и нитрификацией. Интенсивное образование NO3 вызывает обеднение их кислородом и выделением СО2 – становятся анаэробные и создаются условия для денитрификации. Ряд условии, взаимодействие и промежуточных продуктов окисления, при взаимодействии NO3 с фенольными группами и ионами (Mn2+,Fe2+) тяжелых металлов, кислая реакция почвы. Влияние удобрений на урожайность сельскохозяйственных культур и долевое участие азотных удобрений в формировании прибавки (А.В. Петербургский, 1991) Дозы, кг/га Урожайность без удобрений, ц/га (число опытов) Средняя прибавка от удобрений, ц/га N Долевое участие азотных удобрений в прибавке, % Р2О5 К2О 72 56 43,8 81 56 42,0 98 109 37,5 119 95 35,8 Озимая пшеница 25,4 (2225) 8 78 Кукуруза (зерно) 34,3 (516) 10,7 81 Картофель 137,0 (1364) 72 109 Сахарная свекла 266,0 (1608) 110 123 Структура поставок азотных удобрений сельскому хозяйству Форма удобрения Доля продукта в поставках, % 1990 2007 Однокомпонентные удобрения 76 38 Аммиачная селитра 38 28 Мочевина 22 10 Безводный аммиак 6 1 Водный аммиак 10 0 Комплексные удобрения 24 62 в т.ч. в жидких комплексных 2,4 2,6 Влияние различных азотных удобрений на урожайность сельскохозяйственных культур* Прибавка от урожайности (ц/га) от: Культура Урожайность, (ц/га по фону) аммиачной селитры мочевины Мощные и выщелоченные черноземы Сахарная свекла 303 29 34 Кукуруза 47,5 7,8 8,0 Озимая пшеница 24,3 22,9 6,2 1,9 6,0 2,4 Яровая пшеница Обыкновенные и южные черноземы Озимая пшеница Кукуруза 25,4 28,0 3,3 2,7 3,7 3,0 *Примечание: Дозы под зерновые культуры – N30-60, пропашные – N90-120. По разным данным, каждая тонна минеральных удобрений дает дополнительно 10–15 т зерна, 20 – 30 т сена, 30 – 40 т корнеплодов сахарной свеклы, 30 – 50 т зеленой массы кукурузы на силос. N2 + 3Н2 = 2NН3 Для получения нитратных и нитратных удобрений NН3 окисляют NН3 + О2 → NО + Н2О NН3 + О2 → NО → НNО3 аммиачно- NаNО3 содержит 15 – 16 % азота и 26 % натрия. Получают на заводах при производстве азотной кислоты из аммиака. Нитрозные газы обрабатывают раствором соды. NаСО3 + 2NО2 → NаNО3 + NаNО2 +СО2 Для перевода нитрата в нитрат смесь подкисляют слабой НNО3 – 3NаNО2 + 2НNО3 = 3NаNО3 + 2NО2 + Н2О Мелкокристаллическая соль белого или сероватого цвета, хорошо растворяется в воде, гигроскопична, при повышенной влажности крупные кристаллы. перекриталлизуется в более Са(NО3)2 – содержит 13 – 15 % азота. Получается нейтрализацией 40 – 48 % азотной кислоты мелом: СаСО3 + 2НNО3 = Са(NО3)2 + Н2О + СО2 Очень гигроскопична. Хранить во влагонепроницаемых мешках, смешивают с гидрофобными добавками (парафинистый мазут) – 0,5 % массы, добавляют 4 – 7 % аммиачной селитры – получила название – норвежская селитра. Из-за низкого содержания азота в названных удобрениях перевозить их на значительные расстояния экономически не выгодно. Быстро растворяясь в почвенном растворе, селитры вступают в обменные реакции с ППК. Са Са (ППК) +2NаNО3 → (ППК) Nа + Са(NО3)2 Са Nа Н (ППК) Н +2Са(NО3) → (ППК) Са + 2НNО3 (NН4)2SО4 – содержит 20,5 – 21 % азота. (ППК) Н2SО4 + 2NН3 → (NН4)2SО4. Са NН4 + (NН4)2SО4 → (ППК) NН4 + СаSО4. Са Са Вследствие нитрификации азот сульфата аммония переходит в нитратную форму: (NН4)2SО4 + О2 → НNО3 + Н2SО4 + 2Н2О В почве эти кислоты нейтрализуются, вступая с бикарбонатами почвенного раствора. Н2SО4 + Са(НСО3)2 = СаSО4 + 2Н2О + 2СО3 2НNО3 + Са(НСО3)2 → Са(NО3)2 + 2Н2СО3 Безводный NН3 – самое концентрированное безбалластное удобрение – содержание 82,3 % азота. По внешнему виду – бесцветная подвижная жидкость. Температура кипения - 34˚С. чтобы избежать улетучивания аммиака, его хранят и перевозят в стальных цистернах. Аммиачная вода – раствор коксохимического или синтетического аммиака в воде. 2 сорта – первый содержит 20,5 % азота и второй 16,4 % азота можно перевозить и хранить в герметических резервуарах из обычной углеродистой стали. Аммиачная селитра NН4NО3 – содержит 34,6 % нитратного и аммиачного азота. Получают нейтрализацией 56 – 60 % азотной кислоты газообразным аммиаком. Очень взрывоопасна. НNО3 + NН3 = NН4NО3 Мочевина с добавкой лигногутамата Известковая аммиачная селитра Аммиачная селитра с фосфогипсом КЛАССИФИКАЦИЯ МИНЕРАЛЬНЫХ УДОБРЕНИЙ МИНЕРАЛЬНЫЕ УДОБРЕНИЯ МАКРОУДОБРЕНИЯ МИКРОУДОБРЕНИЯ Жидкий аммиак Цианамид кальция Водный аммиак ТРУДНОРАС ТВОРИМЫЕ Суперфосфат двойной Суперфосфат аммонизированн ый Фосфошлак мартеновский Томасшлак Преципитат Фосфоритная мука Костная мука Сульфат калия Калимагнезия Каинит Сильвинит 30- и 40 %-ная калийная соль ТВЕРДЫЕ СЛОЖНЫЕ ПОЛНЫЕ Суперфосфат гранулированный Хлористый калий ЖИДКИЕ СЛОЖНЫЕ НЕПОЛНЫЕ АММИАЧНЫЕ Карбамид ВОДОРАСТВОРИМЫЕ АММОНИЙНОНИТРАТНЫЕ Сульфат аммония Сульфат аммониянатрия Аммиачная селитр Известковоаммиачная селитра ЛИМОННО - И ЦИТРАТНОРАСТВОР ИМЫЕ АММОНИЙНЫЕ Натриевая селитра ЖИДКИЕ НИТРАТНЫЕ Суперфосфат СЫРЫЕ КАЛИЙНЫЕ СОЛИ ТВЕРДЫЕ КАЛИЙНЫЕ КОНЦЕНТРИРОВАННЫЕ ФОСФОРНЫЕ СМЕШАННЫЕ АЗОТНЫЕ КОМПЛЕКСНЫЕ ПОЛНЫЕ И НЕПОЛНЫЕ МНОГОМАРОЧНЫЕ СЛОЖНО-СМЕШАННЫЕ ПРОМЫШЛЕННЫЕ УДОБРЕНИЯ ПРОСТЫЕ Нитрофоска Нитроаммофоска Аммофос Борные (бормагневое) Молибденовые (молибдат аммония) Медные (пиритные огарки) Диаммофос Нитрофос Нитроаммофос СЛОЖНО-СМЕШАННЫЕ СМЕШАННЫЕ Цинковые (сернокислый цинк) Лекция окончена спасибо за внимание!!!