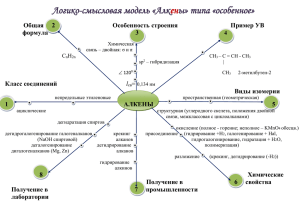
Органическая химия Лекция 2 УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов – УГЛЕРОДА И ВОДОРОДА. С – углерод валентность = 4 Н – водород валентность = 1 АЛКАНЫ А (иначе с ще е уг еводород , п р фи иф тичес ие соеди е ия) — ациклические углеводороды линейного или разветвленного строения, содержащие только простые связи. CnHn+2 , ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением и свойствами, но различающиеся по составу на одну или несколько групп CH2 (гомологическая разность). Гомо огичес ий ряд ов. Изомерия ов • Структурные изомеры (изомерия углеродного скелета). Например, алкан состава C 4H18 может существовать в виде двух структурных изомеров: Радикал – это частица, имеющая не спаренные электроны. Число Название Формула Название числа радикала радикала 1 Моно- -СН3 Метил 2 Ди- -С2Н5 Этил 3 Три- -С3Н7 Пропил 4 Тетра- -С4Н9 Бутил 5 Пента- -С5Н11 Пентил НОМЕНКЛАТУРА АЛКАНОВ 1. Выделяют в структурной формуле наиболее длинную цепь атомов углерода и нумеруют эти атомы, начиная с того к которому ближе разветвление. 1 2 3 4 5 1 2 3 4 СН3 - СН - СН2 - СН2 - СН3 СН3 –СН–СН–СН3 СН3 СН3 СН3 2. Когда радикалов несколько и они равноудалены от концов главной цепи, то нумерацию начинают с того края, к которому ближе расположен простейший радикал. 3. В названии вещества цифрой указывают, при каком атоме углерода находится радикал и называют его (начиная с простейшего). Если радикалы повторяются, то номер повторяют по числу этого радикала, а перед названием радикала приписывают приставку от греческого числительного («ди»-2, «три»-3, «тетра»-4 и т.д.) а) 2 - метил… б) 2,3 – диметил… 4. Если радикалов несколько, то цифрами указывают каждого из них. 5. Завершают название алкана по числу атомов углерода в нумерованной цепи. а) 2 – метилпентан б) 2,3 - диметилбутан Пример построения названия: 2,2,4-триметил-3-этилгексан ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН3 2,2 - диметилбутан СН3–СН2–С–СН3 СН3 СН3– СН – СН – СН – СН3 СН3 С2Н5 СН3 2,4 – диметил - 3 – этилпентан ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ алканы СН4 С2Н6 название Метан Этан агрегатное температура состояние кипения Бесцветные газы. -161 Плохо растворимы в -88 воде. С3Н8 С4Н10 Пропан Бутан На воздухе горят. -42 Ядовиты, вызывают -0,5 тяжелый наркоз. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ алканы С5Н12 название Пентан агрегатное температура состояние кипения Бесцветные +36 жидкости с С6Н14 С7Н16 Гексан Гептан запахом. В воде +68 +98 нерастворимы, С8Н18 Октан +125 легче воды, С15Н32 Пентадекан на воздухе горят. +270 ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ Алканы от н-С17Н36 и выше – твердые вещества белого цвета, нерастворимы в воде, легче воды, на воздухе горят. Не ядовиты. называют ещё и болотным газом. Образуется в результате Природный газ на 95% состоит из метана Ре ции о ис е ия А). Горе ие СnН2n+2 +(1,5n+0,5)O2 → nCO2+ (n+1)H 2O Б). К т итичес ое о ис е ие При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C) могут образоваться: 6. метиловый спирт: 2СН4 + О2 → 2СН 3ОН; 7. формальдегид: СН4 + О2 → СН 2О + Н 2O; 8. муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O. Термичес ие превр ще ия • Для метана: – CH4 → С + 2H2 — при 1000 °C. • Частичный крекинг: – 2CH4 → C2H2 + 3H2 — при 1500 °C. Ре ции э е трофи ь ого з меще ия – Изомериз ция: Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C 4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2метилпропан. – С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют. По уче ие. • Гидриров ие епреде ь х уг еводородов Из алкенов – CnH 2n + H2→ CnH 2n+2 Из алкинов – CnH 2n-2 + 2H2 → CnH 2n+2 Катализатором реакции являются соединения никеля, платины или палладия • Ре ция Вюрц – 2R—Br + 2Na = R—R + 2NaBr Реакция идѐт в ТГФ при температуре −80 °C[10]. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`) • Си тез Фишер — Тропш – nCO + (2n+1)H2 → CnH2n+2 + nH 2O • Г зифи ция твердого топ ив Проходит при повышенной температуре и давлении. Катализатор — Ni: – C+2H2 → CH4 • Газообразные алканы получают из природного и попутного нефтяных газов; • Жидкие и твердые – из нефти. 3. Изомеризация алканов: • Гидрирование непредельных углеводородов : 2. Реакция Вюрца- взаимодействие натрия с галогенпроизводными алканов: Если в реакцию вступают различные галогеналканы, то образуется смесь алканов. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑ карбид алюминия Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека ИСПОЛЬЗОВАНИЕ АЛКАНОВ Алканы являются главным источником органического химического сырья для промышленности. Паpафин (смесь твеpдых углеводоpодов С19-С35) - белая твеpдая масса без запаха и вкуса (tпл= 50-70°C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д. Парафин нетоксичен и широко применяется в пищевой промышленности для пропитки тары и упаковочных материалов (например, пакетов для молока), при производстве жевательных резинок. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров (капрон, найлон). Высшие алканы входят в состав смазочных масел Циклопропан используется для наркоза Метан: производство шин, краски Соединения алканов применяются в качестве хладагентов 4. домашних холодильниках Производство пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти. ИСПОЛЬЗОВАНИЕ АЛКАНОВ 5.народном хозяйстве алканы являются основным энергетическим ресурсом .