Аминокислоты и белки
реклама
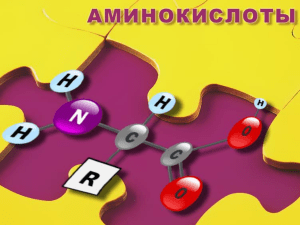
Аминокислоты и белки Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью α-аминокислот ( proteios, греч. - первый) В живых организмах аминокислотный состав белков определяется генетическим кодом. α-Аминокислоты – мономеры для синтеза белков В природе обнаружено более 300 аминокислот, однако в составе белков встречается только 20 (α-аминокислоты) Классификация аминокислот Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильная и аминогруппа группы Карбоксильная группа 1. Структурная классификация 1.1. Взаимное расположение групп СОО- и NH2- Радикал 2 или α 2-аминоэтановая кислота -аминоуксусная кислота глицин 3-аминобутановая кислота -аминомасляная кислота Аминогруппа 1.2. Природа радикала (R): алифатические, ароматические, гетероциклические лейцин антраниловая кислота гистидин 1.3. Количество групп СОО- и NH2- : моноаминокарбоновые, моноаминодикарбоновые, диаминокарбоновые глицин аспарагиновая кислота лизин Протеиногенные аминокислоты («рождающие протеины») - природные аминокислоты, участвующие в построении молекул пептидов и белков Незаменимые аминокислоты 1 Аланин (Ala) 6 2 Валин (Val) 7 3 Лейцин (Leu) 8 Лизин (Lys) Треонин (Tre) (Метионин (Met) 9 4 Фенилаланин (Phe) Изолейцин (Ile) 10 Триптофан (Try) 11 Гистидин (His) 5 Аргинин (Arg) 1) 2) 3) Глицин, аланин, аспарагиновая кислота, 4) аспарагин, 5) глутаминовая кислота, 6) глутамин, 7) оксилизин, 8) серин, 9) цистин, 10) тирозин, 11) 3,5-дибромтирозин, 12) 3,5-дииодтирозин 13) пролин, 14) оксипролин, 15) тироксин Конфигурация протеиногенных аминокислот Конфигурация – расположение атомов, характеризующее определенный стереоизомер R,S – номенклатура L,D - номенклатура L,D – номенклатура используется для аминокислот и углеводов R,S – номенклатура (см. Р. Моррисон, Р. Бойд. ? Органическая химия, с. 87) L-аминокислота (+) –Аланин (-) -Аланин L –глицериновый альдегид Кислотно-основные свойства аминокислот Высокие Тпл. (200-350С); растворимы в воде; нерастворимы в неполярных органических растворителях. Биполярные ионы, цвиттер-ионы Изоэлектрическая точка - значение рН среды, при котором аминокислота существует преимущественно в виде цвиттер-иона Аминокислоты – амфотерные соединения Синтез аминокислот 1. Аминирование α-галогенкислот Р. Геля-Фольгарда-Зелинского 2. Фталимидный синтез по Габриэлю α-хлорэфир карбоновой кислоты Реакции аминокислот Реакции, характерные для COO-группы Реакции, характерные для NH2-группы Реакции, характерные для R Синтез пептидов Пептидная связь глицин глицин глицилглицин, Gly-Gly дипептид Общая схема синтеза пептида Защита аминогруппы и активация карбоксильной Образование пептидной связи Снятие «защиты» Карбобензоксихлорид, бензилхлоркарбонат Нобелевская премия 1955г. за впервые осуществленный синтез полипептидного гормона Винсент Дю Виньо Строение инсулина Фредерик Сенгер, (США) Нобелевская премия, 1958 г. Белки Первичная структура последовательность аминокислот в полипептидной цепи Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями Третичная структура – пространственное строение полипептидной цепи (ковалентные, ионные связи, гидрофильно-гидрофобные взаимодействия) Четвертичная структура – взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса Глобулярные белки полипептидные цепи плотно свёрнуты в компактные шарообразные структуры (глобулы) Фибриллярные белки полипептидные цепи, имеющие вытянутую нитевидную структуру Трехмерная структура молекулы гемоглобина Растворимы в воде или водных растворах кислот, оснований, солей. Не растворимы в воде. К глобулярным белкам относятся ферменты, иммуноглобулины, транспортные и регуляторные гормоны, антитела, альбумин яиц, гемоглобин, фибриноген, фибрин К фибриллярным белкам относятся α-кератины, коллаген, фиброин.