13x301
реклама

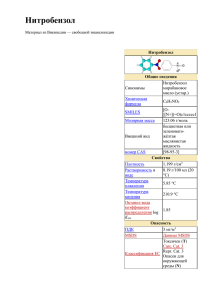
ВЫПОЛНИЛА: КОМАНДА КоРоМыСЛО ( N 13x301) Горловского УВК «ОШ N 22многопрофильный лицей» г. Горловка Донецкой обл. Украина РУКОВОДИТЕЛЬ: РОМАНЮК О. А. Кто он? Александр Порфирьевич Бородин Николай Николаевич Зинин Николай Михайлович Бутлеров О нём писали: «Если бы он не сделал Он обладал исключительной памятью Его год он рождения совпал с годом и В 1830 году поступает напревращения математическое ничего более, кроме В отделение Казани читает лекцииначитанностью. по органической отличался большой философского факультета начала Отечественной войны года, нитробензола в анилин, то и1812 тогда его К нему за справками химии обращались и физики, и Казанского университета имя осталось бы записанным родился недалеко от границы сзолотыми Ираном химики, и математики, и медики буквами в истории химии» Щелкните мышкой на правильный ответ Подумай еще Вернуться к вопросу Анилин образуется при восстановлении нитробензола: С6Н5NO2 + 6[H] → C6H5NH2 + 2H2O Эта реакция носит имя русского химика Н.Н. Зинина • Саксонский химик Унфердорбен, нашел в 1826 г. между продуктами сухой перегонки индиго маслянистое вещество, названное им кристалином. • Несколько лет спустя Рунге в Берлине открыл в каменноугольной смоле соединение, дающее с хлорной известью фиолетовое окрашивание. Основываясь на этом свойстве, он дал ему название цианода (голубого масла). • Поздние академик Фрицше в Петербурге изучал продукты, получающиеся при действии едкого калия на индиго, и нашел при этом маслянистое е вещество с основными свойствами которое назвал анилином, от португальского названия индиго -"Anil". • Наконец, в 1842 г., русскому химику Н. Н. Зинину удалось из бензола, заключающегося в каменноугольной смоле, получить вещество, названное им бензидамом. • В следующем году Гофман доказал, что четыре вещества: кристаллин, цианол, анилин и бензидам тождественны между собою, но право гражданства утвердилось только за названием " анилин ". Существуют разные способы получения анилина. Сырьем служит вещество нитробензол, имеющее формулу C6H5NO2. Первоначально нитробензол подвергали прямому гидрированию с использованием катализаторов и высоких температур. Реакция идет следующим образом: C6H5NO2 + 3H2 = C6H5NH2 + 2H2O Ее достоинство – простота и невысокая стоимость реагентов. Недостаток – низкий выход целевого продукта В промышленном способе производства для восстановления нитробензола используются соляная кислота и железные или чугунные опилки. Все эти вещества загружаются в реактор; образующийся водород в наиболее активной своей форме – «в момент выделения» – энергично восстанавливает нитробензол в анилин. В школьном опыте получения анилина для ускорения реакции вместо железа используем цинк (можно использовать олово). В колбу емкостью 100 мл вносим 2–3 капли нитробензола, приливаем 2 мл концентрированной соляной кислоты и вносим 3 маленьких кусочка цинка. Так как реакция идет слишком бурно, колбу охлаждаем в стакане с водой. Когда запах нитробензола исчезнет или почти исчезнет, в колбу приливаем концентрированный раствор щелочи (40-процентной) до тех пор, пока образующийся вначале осадок гидроокиси цинка Zn(ОН)2 ввиду своей амфотерности не растворится при дальнейшем прибавлении щелочи: Zn(ОН)2 + 2NаОН Na2ZnО2 + 2Н2О Это будет гарантией того, что щелочь выделит анилин из хлористоводородной соли. Чтобы констатировать образование анилина, присоединяем к колбе холодильную трубку и отгоняем около 0,5–1 мл жидкости. Анилин находится вместе с парами воды в виде белой эмульсии. Разбавляем дистиллят водой, чтобы анилин растворился, и открываем его с помощью раствора хлорной извести. Одновременно убеждаемся, что нитробензол не дает окрашивания хлорной известью. При взаимодействии анилина с хлорной известью даже при очень слабом растворе анилина образуется характерное фиолетовое окрашивание. Хлорная известь поэтому служить реактивом на анилин. может Предельно допустимая концентрация анилина в воздухе рабочей зоны 3 мг/м3. В водоёмах (при их промышлен ном загрязнении) 0,1 мг/л (100 мг/м3). Анилин - очень сильный яд, который положено хранить только закрытым и с надписью «яд». •При работе с анилином нужно остерегаться вдыхания его паров. •Лучше всего хранить анилин только в виде разбавленного спиртового раствора. Первая помощь при отравлении анилином: •промывание желудка с активированным углем, вазелиновым маслом, •солевые слабительные, •яичные белки, •горячее питье, •согревание тела. При попадании на кожу: обмывание пораженных мест раствором перманганата калия, водой и мылом. Заслуга Николая Зинина в том, что он экспериментальным путем нашел наиболее эффективный способ превращения нитробензола в анилин. Этот способ заключается в воздействии на нитробензол сульфидом аммония. Реакция протекает таким образом: С6H5NO2 + 3(NH4)2S = C6H5NH2 + 6NH3 + 3S + 2H2O Помимо анилина, образуется элементарная сера и выделяется аммиак, который тут же частично связывается водой. Второй в мире цех по производству анилина каталитическим гидрированием нитробензола на Березниковском заводе (Россия) Таким образом, Н.Зининым был открыт общий метод получения аминопроизводных из органических нитросоединений. После открытия Зинина стало возможным получать анилин в промышленном масштабе. Это заложило научную основу для развития анилинокрасочной промышленности. С производства красителей взяла свое начало промышленность органического синтеза. Схема применения анилина в современных условиях Проявитель в фотографии (гидрохинон) Лекарственные соединения (стрептоцид) Гербициды (бетанал) Полиуретан Красители (родамин, мовеин) Индикаторы (метиловый оранжевый) Искусственный каучук Взрывчатые вещества (тетрил)