Лекция 4. Пористая структура катализаторов, методы
реклама

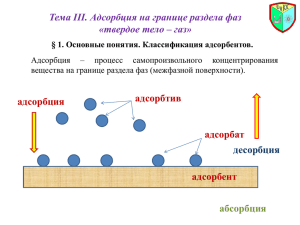
Промышленный катализ и моделирование химических производств Лекция № 4 Пористая структура катализаторов, методы исследования Лектор – к.т.н., доцент кафедры ХТТ Юрьев Е.М. Основные этапы становления теорий приготовления катализаторов • 1938 г. - возникновение теории полимолекулярной адсорбции БЭТ; • 1940-50 гг. – развитие методов измерения активности в лабораторных условиях, возникновение термина «удельная каталитическая активность»; • 1960-70 гг. – развитие новых методов исследования объема и поверхности твердых тел (ЯМР-, ЭПР-спектроскопия, атомноадсорбционный анализ и т.д.); • 1980-2000 гг. – современные методы - нанотехнологии Эмпирический/интуитивный подбор Конец 19 в. – начало 20 в. Сферические частицы мезопористого алюмосиликата, на поверхности которых находятся нанокристаллы серебра Теоретическое физико-химическое «программирование» свойств Вторая половина 20 в. Основные задачи теории и практики приготовления катализатора 1. Получение заданного химического и фазового состава. 2. Получение заданной удельной поверхности. 3. Получение заданной пористой структуры. Активность единицы объема катализатора Основные характеристики пористой структуры: -удельный объем пор; -удельная (внутренняя) поверхность; -радиус/диаметр поры; -распределение пор по размерам; -доля свободного объема (пористость); -истинная и кажущаяся плотности; Пористая структура: - Развитие внутренней поверхности – удельная поверхность; - Характер диффузионных процессов. В зависимости от активности катализатора и кинетических характеристик есть оптимальная (!) пористая структура, например: - монодисперсная; - бидисперсная; - полидисперсная. После химического состава катализатора пористая структура наиболее важный параметр. Твердые тела: - Корпускулярные системы (ксерогели) – состоят из отдельных беспорядочно упакованных частиц - Аморфные (сфера): силикагель, алюмосиликаты, аморфный гидроксид алюминия, сажа, аэросилы, аэрогели. - Кристаллические (пластина, параллелограмм, куб): байеритный гидроксид алюминия, бемитный гидроксид алюминия. - Губчатые системы – единое тело, пронизанное сетью пор (конусных, цилиндрических, бутылкообразных): активированный уголь (1300 К), боросиликатное стекло, никель Ренея. - Смешанная структура: например, крупные сферические частицы никеля, пронизанные бутылкообразными порами Простая глобулярная модель Сделаем допущение, что: изучаемое тело - совокупность одинаковых сферических частиц, которая приблизительно эквивалентна по своим свойствам рассматриваемому телу корпускулярного строения. Параметры модели: - Размер глобул; - Плотность упаковки (число касаний частиц с соседними). Производные параметры: удельная поверхность, объем пор, их размер. Размер глобул определяется (монодисперсная модель): - С применением микроскопа; - По расчетным формулам Плотность упаковки определяется (монодисперсная модель) по пористости материала: График Карнаухова При расчете переноса вещества внутри поры использует понятие гидравлического радиуса пор Классификация размеров пор (М.М. Дубинин/IUPAC): -Макропоры (более 50 нм); -Мезопоры (2 – 50 нм); -Микропоры (менее 2 нм); Классификация пор по А.В. Киселеву – по типам изотерм адсорбции (4 шт.) Классификация пористых тел по характеру распределения размеров пор: -монодисперсные; -бидисперсные; -Полидисперсные; Первичные частицы -Глобулы (силикагель); -Пластинки (оксиды железа, алюминия); Объединяются: - В агрегаты (первичное объединение); - В агломераты (при повышенных температурах, при прессовании); Монодисперсные – глобулярные структуры, построенные из частиц одного размера и одинаковой формы. При давлениях, близких к атмосферному, наиболее выгодная бидисперсная структура пор. Она соответствует глобулярной модели структуры, слагаемой из мелких глобул, образующих необходимую внутреннюю поверхность и соединенных в более крупные глобулы, пространство между которыми образуют большие транспортные поры. В малых мезопорах (2-50 нм) реализуется кнудсеновская диффузия (длина свободного пробега молекул больше, чем размер пор). Полидисперсные структуры: -существует наиболее вероятный радиус, который принимается за количественную характеристику структуры; -оптимальный радиус – наивысшая скорость реакции; -радиус меньше оптимального – поверхность больше, но возможен переход во внутридиффузионную область; -радиус больше оптимального – поверхность меньше. Идентификация пористой структуры Классификация адсорбентов (Киселев): - На поверхности не содержится никаких ионов (графитированная сажа); - На поверхности есть сосредоточенные положительные заряды (группы =O, =CO); - На поверхности есть сосредоточенные отрицательные заряды (группы –ОН на гидроксилированных оксидах); Идентификация пористой структуры Низкотемпературная адсорбция газов (отклонение не превышает 10 %): - Камеру с образцом дегазируют и вакуумируют, затем осуществляется подача газа небольшими порциями при температуре жидкого азота. Начинается процесс адсорбции. Некоторое число молекул газа садится на поверхность адсорбата, которое постепенно увеличивается, и на поверхности образуется монослой. По мере заполнения поверхности, начинает формироваться следующий слой адсорбата, за ним еще один, и так до тех пор, пока не произойдет насыщение. После этого, давление постепенно снижают, и происходит обратный процесс - десорбция. Идентификация пористой структуры Низкотемпературная адсорбция газов Удельная поверхность пористого материала определяется по следующему уравнению: s уд A s0 N A , где A - максимальная емкость монослоя (т.е. максимальное количество вещества, которое может сорбировать поверхность материала массой 1 кг, при допущении, что адсорбционный слой не превышает одну молекулу), моль/кг; s0 - поверхность, занимаемая одной молекулой адсорбата, м2; N A постоянная Авогадро, число структурных единиц веществ в 1 моль вещества, N A 6,02 1023 моль-1. Если частицы имеют форму сфер одинакового диаметра поверхность твердого тела массой в 1 грамм, определяется выражением Sуд = 6/ρd (м2/г); Идентификация пористой структуры В микропорах: из-за близости стенок пор потенциал взаимодействия с адсорбированными молекулами значительный - величина адсорбции при данном относительном давлении (особенно в области малых значений p/р0) большая: •очень узкие – т.н. ультрамикропоры, для которых характерен эффект возрастания адсорбции; • супермикропоры, которые находятся в интервале между ультрамикропорами и мезопорами. В мезопорах: капиллярная конденсация; на изотермах наблюдается характерная петля гистерезиса; Макропоры настолько широки, что для них невозможно детально изучить изотерму адсорбции из-за ее близости к прямой p/р0 = 1. Классификация, предложенная С. Брунауэром, Л. Демингом, У. Демингом и Э. Теллером I – микропористые, ширина микропор не превышает нескольких диаметров молекул, силовые поля соседних стенок пор перекрываются, и энергия взаимодействия твердого тела с молекулой возрастает (в углеродных адсорбентах, цеолитах, силикагелях), понятие «удельная поверхность» не имеет смысла, возможно определение лишь общего объема микропор; II – непористое/макропористое тело; III – непористое/макропористое тело, слабое взаимодействие «адсорбентадсорбат»; IV – мезопористое, пригодно для расчета удельной поверхности, для оценки распределения пор по размерам; Классификация, предложенная С. Брунауэром, Л. Демингом, У. Демингом и Э. Теллером V – мезо- + макропористое тело, слабое взаимодействие «адсорбентадсорбат»; VI – ступенчатый тип, введен за рамками общепринятой классификации, характерен для некоторых типов цеолитов, которые обладают очень порами постоянного размера (на первой ступени заполняются поры одного размера, на следующей другого, и т.д.); Классификация, предложенная С. Брунауэром, Л. Демингом, У. Демингом и Э. Теллером Допущения теории мономолекулярной адсорбции: 1) поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются (локализуются) молекулы адсорбтива; 2) на одном центре адсорбируется только одна молекула, т.е. при адсорбции образуется только один адсорбционный слой (монослой); 3) адсорбция на данном центре не влияет на адсорбцию на других центрах, т. е. взаимодействием адсорбированных молекул можно пренебречь. 4) адсорбция находится в динамическом равновесии с десорбцией. Допущения теории полимолекулярной адсорбции БЭТ (Брунауэра-Эммета-Теллера): 1) поверхность адсорбента неоднородна энергетически; 2) взаимодействие адсорбент–адсорбат сильнее, чем адсорбат–адсорбат; 3) взаимодействие адсорбированных молекул учитывается только в направлении, перпендикулярном поверхности, и рассматривается как конденсация; 4) Возможно образование второго и последующих слоев за счет взаимодействия адсорбат–адсорбат; Классификация, предложенная С. Брунауэром, Л. Демингом, У. Демингом и Э. Теллером Применяется теория мономолекулярной адсорбции (при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя) – изотерма I: 1) хемосорбция, 2) физической адсорбция газов при небольших давлениях и температурах выше критической (в отсутствие конденсации на поверхности адсорбента) 3) адсорбция из растворов. Применяется теория полимолекулярной адсорбции БЭТ (образуются полимолекулярные слои вещества на поверхности адсорбента): 1) газы и пары адсорбируются при температурах ниже критической (полимолекулярную адсорбцию можно представить как результат вынужденной конденсации пара под действием поверхностных сил) – как правило изотерма II; Идентификация пористой структуры Низкотемпературная адсорбция газов: Допущения теории мономолекулярной адсорбции: p A p 1 p A A K A tg 1 A 1 A K p Допущения теории полимолекулярной адсорбции БЭТ (Брунауэра-Эммета-Теллера): p / ps A(1 p / ps ) p / ps 1 C 1 p A(1 p / ps ) A C A C ps 1 A C tg C 1 A C p ps Идентификация пористой структуры Низкотемпературная адсорбция газов (отклонение не превышает 10 %): -Используются, как правило, для высокодисперсных систем или систем с развитой пористостью; -Адсорбтив – азот (при 77 К), аргон, криптон (при S менее 5 м2/г); при исследовании структуры поверхности – вода и спирты; -Откачка адсорбента: рабочий газ (гелий), T, P определяются природой конкретной системы: оксиды с мезопорами – при 150 °С, микропористые А. (активный уголь, цеолиты) – при 350-400 °С; остаточное давление – до 1,33 Па; время обезгаживания – 6-10 часов; -Измерение адсорбции: - - Объемный статический метод – чаще всего – величину адсорбции вычисляют по известному объему камеры, объему твердого тела, падению давления, количеству поданного газа; Весовой метод – вакуумные микровесы, весы с кварцевыми спиралями, величину адсорбции измеряют непосредственно по увеличению массы твердого тела; Идентификация пористой структуры Низкотемпературная адсорбция газов (отклонение не превышает 10 %): - Камеру с образцом дегазируют и вакуумируют, затем осуществляется подача газа небольшими порциями при температуре жидкого азота. Начинается процесс адсорбции. Некоторое число молекул газа садится на поверхность адсорбата, которое постепенно увеличивается, и на поверхности образуется монослой. По мере заполнения поверхности, начинает формироваться следующий слой адсорбата, за ним еще один, и так до тех пор, пока не произойдет насыщение. После этого, давление постепенно снижают, и происходит обратный процесс - десорбция. Идентификация пористой структуры Низкотемпературная адсорбция газов: Критерии точности расчетов: -Емкость монослоя: - Величина константы адсорбции не должна быть малой (более 50) – изотерма имеет крутой изгиб, точка Б хорошо определяется; -Удельная поверхность: - Величина константы адсорбции не должна быть большой (не более 150) - адсорбат с молекулами сферической формы, слой молекул нелокализованный, энергетически однородный – площадь поверхности одинакова на всех адсорбентах; Считается, что при Sуд > 500 м2/г в образце развита значительная микропористость. Большая, >= 500, величина С также указывает на наличие микропористости Удельная поверхность стандартных образцов, вычисленная на основе a∞(N2) = 0,162 нм2 Причины расхождений: -Несовершенство контроля условий обезгаживания образцов; -Колебания температуры образца в ходе адсорбции; -Нестабильность ДНП адсорбата; -Примеси в азоте; -Разница в сроках поверки аппаратуры; -Ошибка при выборе линейного участка на кривой БЭТ. Теплота адсорбции, изостерическая теплота адсорбции Теплоту адсорбции оценивают из температурных зависимостей адсорбции По уравнению Клапейрона-Клаузиуса можно получить следующую теоретическую изостеру (А=const): ln p const RT Правильность определения емкости монослоя (по уравнению БЭТ) подтверждается зависимостью теплоты адсорбции от величины а/а∞. Обнаружено, что теплоты адсорбции резко уменьшаются вблизи значений а/а∞= 1 (а = а∞) до величин, лишь слегка превышающих молярную теплоту конденсации газа, в соответствии с ожидаемым завершением образования монослоя и началом образования последующих слоев. Теория объемного заполнения микропор Создана Дубининым в 30-х гг. XX в. на основе теории потенциального поля Поляни. Основные постулаты: - Над поверхностью твердого тела существует потенциальное поле, убывающее с удалением от поверхности; - Поле обусловлено силами Ван-дер-Ваальса; - Адсорбция в общепринятом смысле отсутствует, адсорбционный слой формируется за счет конденсации молекул газа в области сильного поля; - Применима только для тонкопористых адсорбентов, размер пор 2-3 нм (например, активные угли); - Поля создаваемые противоположными стенками усиливают друг друга; Следствия: - Величины адсорбции двух разных адсорбатов на одном адсорбенте будут относится как поляризуемость их молекул (коэффициент афинности); - Возможен пересчет изотермы одной температуры на любую температуру; t-график (t-кривая) Гипотеза - изотермы адсорбции данного газа, например азота, на ряде веществ, например оксидах металлов, имеющих различные величины поверхности, но не слишком различающихся по другим свойствам, должны отличаться по форме лишь незначительно. Например, -изменения масштаба оси ординат; -введение нормализованной адсорбции a/a; -введение статистической толщины адсорбционной пленки t = a/aδ (δ - толщина одного молекулярного слоя) Была получена единая «стандартная» изотерма адсорбции азота при 77 К на большом числе образцов в виде зависимости зависимость t= f (p/ps) (δ = 0,354 нм) Гипотеза – стандартные изотермы для любых пар адсорбент—адсорбат можно разделить, исходя лишь из величины константы СБЭТ Для определения удельной поверхности: 1. Строится t-график. 2. Если изотерма стандартная, t-график пройдет через начало координат. 3. Тангенс угла наклона bt=a/δ. 4. Sуд =s0 δ NA bt Метод простой – но не независимый, т.к. используются те же данные что и для расчета по БЭТ. Наибольшая сложность – точное определение δ. Капиллярная конденсация – сжижение пара в порах твердого тела. В порах твердого тела пар способен конденсироваться в жидкость, даже если его относительное давление меньше единицы. ps ps С точки зрения теории капиллярной конденсации: с ростом внешнего давления жидкость конденсируется и мениск заполняется адсорбатом ps ps Радиус кривизны уменьшается, пока пленка адсорбата в горле поры не превратится в ровную поверхность ps ps Чем больше разница между радиусом кривизны адсорбционной пленки и радиусом мениска в горле пор (чем уже пора): -тем большее давление необходимо для заполнения пор по сравнению с давлением опорожнения пор; -тем более заметен гистерезис на кривой адсорбции-десорбции. Гипотеза Мак-Бэна – заполнение бутылкообразных пор происходит при давлении соответствующем 1/r1, а опорожнение - при давлении, соответствующем 1/r2 Правило Гурвича - количество адсорбированного вещества, соответствующее этой области и выраженное в виде объема жидкости (имеющей плотность нормальной жидкости), должно быть одинаковым для всех адсорбтивов на данном пористом теле) Количественное описание – уравнение Кельвина Радиус пор определяется по уравнению Кельвина с учетом принятой модели пор. Поправки: -толщина адсорбционного слоя (соответствует началу гистерезиса); -зависимость поверхностного натяжения от кривизны при малых r. Объем пор определяется по приросту ветви изотермы при данных r (как правило по десорбционной ветке, т.к. не нужна поправка на угол смачивания) Правило Кельвина: равновесное давление пара р над вогнутым мениском жидкости должно быть меньше, чем давление насыщенного пара ро при той же температуре. Следствия: -в порах твердого тела пар способен конденсироваться в жидкость, даже если его относительное давление меньше единицы; -давление пара р над вогнутым мениском должно быть меньше, чем давление насыщенного пара ро; -КК пара в жидкость должна происходить в порах при некотором давлении, определяемом величиной r для жидкого мениска в них; -если мениск всегда вогнутый (т. е. краевой угол менее 90°) это давление должно быть меньше, чем давление насыщенного пара. Образование жидкой фазы из пара при любом давлении, меньшем давления насыщенного пара, не может происходить в отсутствие поверхности твердого тела, которое инициирует процесс конденсации. Почему возникает гистерезис? 1. Гистерезис возможен потому, что процессы конденсации и испарения не являются в точности обратимыми друг другу. Конденсация: адсорбционная пленка играет роль зародышей, на которых происходит конденсация, когда относительное давление достигает величины, определяемой уравнением Кельвина. Испарение: испарение из мениска может происходить спонтанно, как только давление оказывается достаточно низким. 2. Присутствие на стенках пор молекул воздуха, затрудняющих смачивание стенок пор адсорбатом в прямом процессе – адсорбции. Обратный процесс – десорбция – уже не осложнен присутствием воздуха. Изотермы десорбции являются более равновесными, и именно их следует использовать для расчета величины радиусов пор. Вся система заполнена конденсатом Как правило, уравнение Кельвина применяется при r = 1-25 нм. Начало КК в наиболее тонких порах Адсорбция ограничена образованием тонкого слоя на стенках пор Капиллярная конденсация характерна для изотерм адсорбции IV типа. Чем тоньше пора: -тем сильнее адсорбционный процесс преобладает над капиллярноконденсационным; -тем меньше высота гистерезиса; -тем сильнее гистерезис смещен в сторону малых относительных давлений Для широкопористых адсорбентов гистерезисная петля вырождается – размеры мениска (горла поры) сопоставимы с размером внутренней полости поры Плато и резкий вертикальный обрыв на кривой десорбции – однородные и узкие поры Уравнение Кельвина в интегральной форме выглядит следующим образом: r 2 VM , RT ln ps / p где r - максимальный радиус пор, в которых находится адсорбат при данном обратном относительном давлении ps / p , м; - поверхностное натяжение адсорбата при температуре опыта, Дж/м2; VM - мольный объем адсорбата при температуре опыта, м3/моль; R - универсальная газовая постоянная, R 8,314 Дж/моль К; T - температура опыта, К. V d П VП , макс dr VП VП , макс VП VM A r r Минимальный измеряемый радиус пор – около 1,5 нм (микропоры – теория объемного заполнения микропор) Максимальный измеряемый радиус пор – около 100 нм (макропоры - ртутная порометрия, иногда электронная микроскопия) КК наблюдается, как правило, для оксидов металлов и переходных элементов. Оценивается удельная поверхность и распределение пор по размерам Адсорбция в микропорах Изотермы I типа: -углеродные сорбенты (угли); Реже: -ксерогели кремнезема; -диоксид титана; -оксид алюминия или олова; - специально приготовленные цеолиты. В микропорах происходит не покрытие поверхности пор, а их объемное заполнение. Величина адсорбции в точке, близкой к насыщению является мерой объема микропор (требуется пересчет в объем жидкости с использованием плотности жидкого адсорбтива). Адсорбция в микропорах Уравнение Дубинина-Радушкевича позволяет оценить объем микропор по областям изотермы адсорбции, относящимся к малым и средним давлениям. lgVП lgV0 D lg( p pS ) 2 Объем пор адсорбента VП , приходящихся на единицу массы адсорбента, заполненных при данном равновесном давлении адсорбата, определяется по формуле: VП VM A . 1,80E-04 1,60E-04 lg Vп 1,40E-04 1,20E-04 1,00E-04 8,00E-05 6,00E-05 4,00E-05 2,00E-05 0,00E+00 -0,1 0 (lg (p/ps))2 0,1 0,2 0,3 0,4 0,5 0,6 Последовательность интерпретации изотермы 1. Проверка воспроизводимости адсорбции измерением изотермы на другой порции данного образца (т. е. другой его навески). «Петля гистерезиса в области низких давлений?! Тут что-то не так!» 2. Отнесение изотермы к определенному типу, который зависит от природы адсорбционного процесса (моноили полимолекулярная адсорбция, капиллярная конденсация, заполнение микропор). 3. Изотермы 2 и 4 типов: метод БЭТ – оценка константы СБЭТ (проверка на микропоры), интервал линейности графика БЭТ; оценка удельной поверхности. 4. Изотерма 4 типа: уравнение Кельвина - распределение пор по размерам. 5. Изотерма 1 типа: оценка объема пор по величине адсорбции в точке перегиба или по уравнению Дубинина-Радушкевича. Методы исследования размеров пор Ртутная порометрия 1. Пористая гранула катализатора помещается в камеру (ампулу); 2. Камера вакуумируется, потом заполняется ртутью: ртуть облегает поры, не заполняя их; 3. Ртути сообщается избыточное давление: сначала заполняются широкие поры, затем узкие в строгом соответствии с давлением; Согласно Уошберну, давление p, которое необходимо приложить, чтобы заполнить поры радиусом r, зависит от поверхностного натяжения жидкости σ и от краевого угла смачивания θ, определяемого природой жидкости и твердого тела: 2 cos p r Угол θ для ртути и большинства твердых тел составляет 135-150°. Поэтому cosθ≈(-0,87)-(0,71). При атмосферном давлении заполняются поры радиусом более 7,6 мкм; при 300 МПа – все поры с радиусом более 2,5 нм. Ртутная порометрия Одновременно учитывается и увеличение давления и объем ртути, поглощенный телом. 2 cos p r Вычисление плотности Кажущаяся плотность – по несмачивающей жидкости (ртуть) Истинная плотность – по смачивающей жидкости (бензол или гелий) Модель цилиндрических пор Модель щелевых пор Простая глобулярная модель (регулярная упаковка) Какая пористая структура выгоднее? Для химической реакции с постоянным известным молекулярностью; для катализатора неизменного состава поверхности: б – бидисперсная, м – монодисперсная структуры. Kб DoT M б (1 б ) 1,85 Км p м Rmic. glob м механизмом, и удельной Моделирование каталитических процессов и реакторов / В. С. Бесков, В. Флокк. — Москва: Химия, 1991. — 256 с. Следствия: - Переход к БДС актуален для процессов при небольших давлениях и больших температурах; - Молекулярная масса газа слабо влияет на выбор дисперсности катализатора; - Если размер глобул около 50 нм (средний для большинства катализаторов) переход к БДС увеличивает активность объема катализатора в 2-4 раза (для основных процессов); - При средних давлениях (10-15 атм) оптимальна монодисперсная структура с Rmic.glob=10-50 нм; - При давлении выше 50 атм выгодна однородная пористая структура с радиусом пор = длине свободного пробега молекул (2-15 нм) – увеличивается вдобавок уд.пов-ть; - Эффект от перехода к БДС не зависит от размера макроглобул, увеличение Rmac.glob при приготовлении менее затратно, однако при увеличении Rmac.glob снижается механическая прочность, поэтому не следует делать их больше 1-5 мкм; - Максимум активности БДС структуры достигается уже при координационном числе 4-6 (неплотная упаковка) – по графику Карнаухова; Макрокинетические области протекания каталитических процессов Внешние области: - Теория стационарной конвективной диффузии Нернста (1904 г.); - Непористое зерно катализатора; - Линейный размер поверхности существенно превосходит длину пути диффузии; - Концентрация веществ изменяется по нормали к поверхности; - Стационарный режим; - Реакция первого порядка с одним исходным веществом; vch.r . k D CV ; k Внешнекинетическая область: - Отсутствие зависимости скорости процесса от размеров зерен катализатора и его пористости, линейной скорости потока, условий его перемешивания; - Быстрое увеличение скорости процесса с ростом температуры; Внешнедиффузионная область: - Зависимость скорости процесса от размеров зерен катализатора, линейной скорости потока, интенсивности перемешивания; - Слабая зависимость скорости процесса от температуры; - Отсутствие зависимости скорости диффузии от пористости катализатора и диффузионного сопротивления от времени; Промежуточная область; Макрокинетические области протекания каталитических процессов Внутренние области: - Внутренняя диффузия обусловлена разностью концентраций у входа в пору и внутри пор; - Равенство концентраций реагента у входа в пору и в объеме; - Узкие поры: кнудсеновская диффузия - эффективный коэффициент диффузии пропорционален диаметру поры d; - Широкие поры: молекулярная диффузия, закон Фика - эффективный коэффициент диффузии пропорционален длине свободного пробега молекул l; - Кинетическая задача Зельдовича: - 1) Пористое зерно катализатора – однородная неподвижная среда; - 2) Модельная пора – направлена вдоль максимального градиента концентрации реагента от устья поры к центру зерна; - 3) Адсорбция реагента на поверхности катализатора не учитывается; При каких размерах поры d скорость будет лимитироваться химической реакцией??? Deff / keff 3, 6d Внутрикинетическая область: - Скорость процесса не зависит от размера пор (и зерен катализатора); Deff / keff 0,1d Внутридиффузионная область: - Концентрация в центре зерна близка к нулю – внутренний массоперенос затруднен; Макрокинетические области протекания каталитических процессов Внутренние области: - Кинетическая задача Тиле: - 1) Цилиндрическая пора; - 2) Модельная пора – направлена вдоль максимального градиента концентрации реагента от устья поры к середине плоской пластины; - 3) Адсорбция реагента на поверхности катализатора не учитывается; - 4) Реакция первого порядка; При каких параметрах катализатора и реакции скорость будет лимитироваться химической реакцией??? hl Внутрикинетическая область: - Наблюдаемая скорость реакции максимальна – нет градиента концентрации вещества по длине поры; h 0, 2 Внутридиффузионная область: - Существенное уменьшение концентрации внутри поры – степень использования поверхности уменьшена; h2 - Скорость зависит от диаметра зерна, радиуса, извилистости пор катализатора; Скорость не зависит от скорости движения газа и интенсивности перемешивания; 2k rD Повышение температуры «вытесняет» каталитическую реакцию на поверхность, а затем и в объем реакционной среды Для САМОСТОЯТЕЛЬНОГО освоения: 1) Байрамов В.М. Основы химической кинетики и катализа Учеб. пособие для студ. высш. учеб. заведений — М.: Издательский центр «Академия», 2003. — 256 с. Раздел 10.7. МАКРОКИНЕТИКА ГЕТЕРОГЕННОКАТАЛИТИЧЕСКИХ ПРОЦЕССОВ 2) Г. М. Панченков. В. П. Лебедев. Химическая кинетика и катализ. Учебное пособие для вузов. — М., Химия, 1985. ГЛАВА IX. ЭЛЕМЕНТЫ ДИФФУЗИОННОЙ КИНЕТИКИ ХИМИЧЕСКИХ РЕАКЦИЙ 3) Крылов О.В. Гетерогенный катализ. – М.: ИКЦ «Академкнига», 2004. Пункт 3.6. ДИФФУЗИОННАЯ КИНЕТИКА