Молекулярная физика и термодинамика Учитель ВКК Гудова Г.Н.
реклама

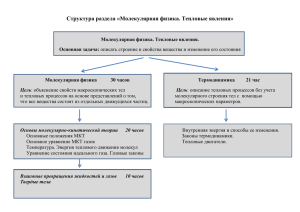
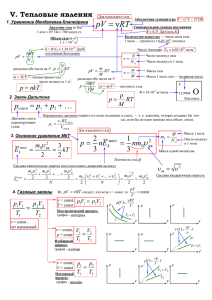
Молекулярная физика и термодинамика Учитель ВКК Гудова Г.Н. МКОУ Калачеевская СОШ №1 Основные понятия O Молекула- мельчайшая частица вещества, обладающая всеми его свойствами O Атом - частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. O Идеальный газ - теоретическая модель газа. Пренебрегается взаимодействием частиц газа (средняя кинетическая энергия частиц много больше энергии их взаимодействия) Основные понятия O Диффузия - процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого при взаимном соприкосновении. O Броуновское движениебеспорядочное движение микроскопических видимых, взвешенных в жидкости или газе частиц твердого вещества, вызываемое тепловым движением частиц жидкости или газа. Основные понятия O Количество вещества ( 𝜈) — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество. O 1 моль— это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах углерода Основные понятия O 1 моль— это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах углерода O Молекулярная масса- (Mr) – это число, показывающее во сколько раз масса данного вещества больше массы 1/12 атома углерода. O Молярная масса- масса 1 моля вещества Основные понятия O Абсолютный нуль температуры – O O O O минимальный теоретический предел температуры, который может иметь физическое тело. t= - 273,15 0С соответствует Т = 0 К NA=6•1023 1/моль, (число Авогадро) k= 1,38•10 -23 Дж/К (пост. Больцмана) R= 8,31 Дж/моль К (газовая постоянная) Молекулярная физика Основные положения МКТ: O 1. Все тела (вещества) состоят из частиц между которыми есть промежутки. O 2. Частицы находятся в постоянном, беспорядочном движении. O 3. Частицы вещества взаимодействуют друг с другом: притягиваются на небольших расстояниях и отталкиваются, когда эти расстояния уменьшаются Молекулярная физика O Масса: m0 = M NA (масса молекулы) 𝑵 𝒎= ∙𝑴 (масса вещества) 𝑵𝑨 O Количество вещества: ν= m M , ν= N NA O Концентрация (количество молекул в единице объема): 𝒏= 𝑵 𝑽 Молекулярная физика O Связь температурных шкал: T=273+t Молекулярная физика O Давление газа создается ударами беспорядочно движущихся молекул о дно и стенки сосуда: O 𝑝= O 𝑝= 1 3 1 3 𝑛 𝑚0 𝑣 2 , 𝜌 𝑣 2, O p=n k T, O 𝑝= 2 3 𝑛 𝐸𝑘 . O Диаметр молекулы: 𝑎 = 3 𝑀 𝜌∙𝑁𝐴 Молекулярная физика O Скорость движения молекул: 𝑣= 3𝑘𝑇 𝑚0 R = 8,31 O , 𝑣= 3𝑅𝑇 𝑀 . Дж моль∙ К Энергия теплового движения молекул: 𝐸= 𝑚0 𝑣 2 2 , 𝐸= 2 3 𝑘 𝑇. Молекулярная физика O Уравнение Менделеева – Клапейрона: 𝑚 𝑀 𝜌𝑅𝑇 𝑀 𝑝𝑉 = 𝑅𝑇 𝑝= 𝑝𝑉 = 𝜈𝑅𝑇 O Уравнение Клапейрона: 𝑝𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑇 𝑝1 𝑉1 𝑝2 𝑉2 = 𝑇1 𝑇2 Газовые законы O Бойля-Мариотта O T=const; p1V1=p2V2 O Изотермический Газовые законы O Гей - Люссака O p=const; O Изобарный 𝑉1 𝑇1 = 𝑉2 𝑇2 Газовые законы O Шарля V=const; O Изохорный 𝑝1 𝑇1 = 𝑝2 𝑇2 Термодинамика O Внутренняя энергия - тела это суммарная энергия теплового движения его частиц (кинетическая) плюс потенциальная энергия их взаимодействия друг с другом. O 𝑈= 3 𝑚 ∙ 𝑅𝑇 2 𝑀 (для одноатомного газа) O Работа при постоянном давлении: А= p∙ΔV Термодинамика 1 закон термодинамики: O ΔU= Q + A Внутреннюю энергию можно изменить передачей теплоты (теплопроводность, конвекция, излучение) или совершением работы. O Q= ΔU + A΄ Количество теплоты, переданное системе идет на изменение внутренней энергии и на совершение работы. где А – работа, совершенная над газом (газ сжали), A΄– работа газа (газ расширился) Термодинамика Площадь фигуры под графиком давления численно равна работе Термодинамика Применение 1 закона термодинамики к изопроцессам: O 1. Изотермический: T= const, ΔT=0, Q=A΄ (вся теплота идет на совершение работы) O 2. Изобарный: p=const, , Q=5/2νRT, Q= 5/2 pΔV O 3. Изохорный: V=const, ΔV=0, A΄ =0, Q = ΔU (Вся теплота идет на изменение внутренней энергии). O 4. Адиабатный: (процесс, происходящий без теплообмена с окружающей средой) Q=0, A΄ = - ΔU (Работа совершается за счет уменьшения внутренней энергии) Термодинамика O Коэффициент полезного действия: 𝜂 = 𝐴 𝑄1 ∙ 100% O 𝐴 = 𝑄1 − 𝑄2 O 𝜂= 𝑄1 −𝑄2 𝑄1 ∙ 100% O Для идеального теплового двигателя: 𝜂= Т1 −Т2 Т1 𝑄2 𝑄1 = Т2 Т1 ∙ 100%, Агрегатные состояния вещества АВ –нагревание твердого тела, в кристаллической решетке молекулы колеблются интенсивнее. ВС – плавление, разрушается кристаллическая решетка. CD- нагревание жидкости, молекулы жидкости движутся быстрее. DE-испарение при кипении, молекулы покидают жидкость. ЕF- нагревание пара, молекулы пара движутся быстрее. FMNKTP – обратный процесс: остывание пара, конденсация, остывание жидкости, кристаллизация, остывание твердого тела. Агрегатные состояния вещества Нагревание(остывание) , Q = cm Δt, с – удельная теплоемкость – количество теплоты, необходимое для нагревания 1 кг вещества на 10С (1К) O Плавление (кристаллизация) Q = ± λm , λ –удельная теплота плавления – количество теплоты, необходимое для плавления 1 кг кристаллического вещества, взятого при температуре плавления Испарение (конденсация) Q=±rm r - удельная теплота испарения – количество теплоты, необходимое для испарения1 кг жидкости, взятой при температуре кипения O Агрегатные состояния вещества O Влажность – отношение парциального давления пара к давлению насыщенного пара при данной температуре 𝑝 𝜑 = ∙ 100% 𝑝н O Насыщенный пар – пар, находящийся в термодинамическом равновесии со своей жидкостью (зависит только от температуры). O Точка росы – температура, при которой водяной пар, содержащийся в воздухе становится насыщенным. Психрометр Агрегатные состояния вещества Кристаллическое Аморфное Есть определенная t плавления Нет определенной t плавления Анизотропны Изотропны (физические (физические свойства тела по всем направлениям различны) свойства тела по всем направлениям одинаковы) Дальний порядок расположения молекул Ближний порядок расположения молекул Спасибо за внимание!