ФИЗИКА Модуль 2 Молекулярная физика и термодинамика УГТУ-УПИ
реклама

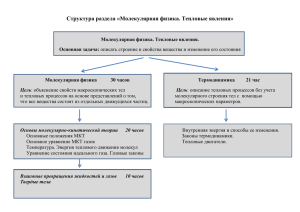
УГТУ-УПИ ФИЗИКА Модуль 2 Молекулярная физика и термодинамика Лекционная презентация Е.С. Левин Научный редактор – профессор, доктор физико-математических наук А.А. Повзнер Екатеринбург 2007 Модуль 2. Молекулярная физика и термодинамика. Молекулярно-кинетическая теория Л7-10 Распределение Максвелла-Больцмана Л8-13. Явление переноса Л9-10. Первое начало термодинамики Л10-11. Изопроцессы. Энтропия Л11-10. Второе начало термодинамики. Цикл Карно Л12-14. Модуль 2: лекций 6 (12часов), 68 слайдов. Молекулярная физика (Волькенштейн-1990 г) МКТ 5.21 5.22 5.26 5.28 Распределение Максвелла 5.50 5.55 5.56 5.93 5.94 Явления переноса 5.139 5.145 5.146 5.141 Модуль 2 Лекция 7 3 Молекулярная физика – это раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их микроскопического (молекулярного) строения. Если классическая механика рассматривает лишь внешние взаимодействия макроскопических тел, их движение в целом, то статистическая физика и термодинамика изучают внутренние свойства макроскопических систем и те происходящие в них процессы, которые являются результатом атомных и молекулярных явлений. Модуль 2 Лекция 7 4 Объектом исследований статистической физики и термодинамики являются макроскопические системы, состоящие из очень большого числа частиц. Статистика исходит из законов механики и теории вероятности, термодинамика – из фундаментальных опытных фактов превращения одних видов энергии в другие. Модуль 2 Лекция 7 5 Внешние параметры V, Sпов., Еэл.поля, Вмагн.поля зависят от взаимного расположения окружающих систему тел. Внутренние параметры Т, Р, ρ, n Модуль 2 Лекция 7 6 Опытное обоснование молекулярнокинетической теории 1. 2. 3. 4. 5. 6. Высокая сжимаемость газов свидетельствует о наличии больших расстояний между молекулами. Стремление газа занять весь объем говорит о независимости движения молекул. Диффузия – молекулы движутся в «пустотах». Смешение жидкостей (вода+спирт) – объем смешения не равен объему компонентов. Рост давления газа связан с относительным увеличением ударов молекул о стенки. Броуновское движение – неуравновешенность ударов молекул. Модуль 2 Лекция 7 7 Абстракции молекулярной физики Идеальный газ – газ, частицы которого на расстоянии не взаимодействуют, а при столкновениях ведут себя как упругие шары, собственный объем частиц значительно меньше объема, занимаемого газом. 1. Идеальный газ – собрание большого числа молекул, которые рассматриваются как материальные точки. 2. Между столкновениями молекулы двигаются равномерно и прямолинейно. Скорости их равновероятны по направлениям. 3. Давление газа – результат взаимодействия молекул газа со стенками сосуда. 4. Каждая молекула обладает энергией, которая пропорциональна абсолютной температуре. Модуль 2 Лекция 7 8 2 кв 2 2 m0 v P n Ek n 3 3 2 2 кв m0 v 2 3 kT 2 P nkT PV const T Основное уравнение МКТ для давления (Уравнение Клаузиуса) Основное уравнение МКТ для температуры PV NkT Уравнение состояния ид.газа Объединенный газовый закон Модуль 2 Лекция 7 9 Постоянная Больцмана K=1,38∙10-23 Дж/К Моль – количество вещества, содержащего столько же структурных элементов (молекул, атомов), сколько атомов содержится в изотопе углерода 12С массой 0,012 кг. Молярная масса М, кг/моль–масса 1 моля Число молей m (m – масса газа, кг) M Постоянная Авогадро NA=N0=6,023∙1023 1/моль – число молекул в 1 моле NA M , где m0 – масса одной молекулы m0 В 1 моле разных веществ содержится одинаковое NA число молекул. Модуль 2 Лекция 7 10 M=m0NA m M Смесь газов – Мэф . m М эф M эф 1 2 ... n m mn m1 m2 ... M1 M 2 Mn Модуль 2 Лекция 7 11 P(V)=N0kT R=N0k R=8.31Дж/моль∙К R – универсальная газовая постоянная P(V)(m/M)=(m/M)RT PV=(m/M)RT Уравнение Менделеева-Клапейрона для произвольной массы газа Модуль 2 Лекция 7 12