RT pV ν =
реклама

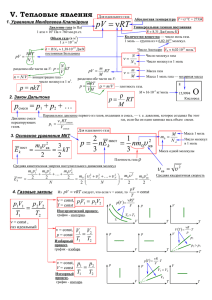
V. Тепловые явления 1. Уравнение Менделеева-Клапейрона Для идеального газа pV = νRT Универсальная газовая постоянная R ≈ 8,31 Дж/(моль⋅К) Количество вещества — число моль газа. 1 моль — группа из ≈ 6,02⋅1023 молекул. Давление газа (в Па) 1 атм ≈ 105 Па ≈ 760 мм.рт.ст. Объем газа (в м3) 1 л = 10-3 м3 pV = k = R/NА ≈ 1,38⋅10-23 Дж/К постоянная Больцмана NRT NA N разделим обе части на V: p = kT V n = N/V — концентрация газа - Число Авогадро NА ≈ 6,02⋅1023 моль-1 pV = 3 число молекул в 1 м . p = nkT mRT VM 2. Закон Дальтона pсмеси = p1 + p2 + … Давление смеси нереагирующих газов. ν= N NA Число молекул газа ν= m M Масса газа Число молекул в 1 моль Масса 1 моль газа — молярная масса 8 ρ = m/V — плотность газа. ρ p = RT M p1 = 1 E m0v 2 Vсмеси Для идеального газа 2 кв = 2 1 пост p = nE k = nm0v кв2 3 3 3 kT 2 4. Газовые законы p1V1 p 2V2 = T1 T2 2 ⎞ m0 v m v2 ⎟⎟ = = 0 кв , 2 2 ⎠ pV Из pV = νRT следует, что если ν = const, то = const T νRT ν = const, p V = p V p (V ) = 1 1 2 2 р р T = const V Изотермический процесс, график - изотерма. V1 V2 = T1 T2 Масса 1 моль Число молекул в 1 моль Масса одной молекулы p1 p2 = T1 T2 Изохорный процесс, график - изохора. v кв = v 2 Средняя квадратичная скорость V V T T V (T ) = р Изобарный процесс, график - изобара ν = const, V = const M NA T2 > T1 T1 ν = const, p = const m0 = Плотность газа ρ m0v 12 m0v 22 m0v N2 + +K+ 2 2 2 2 2 = m0 ⎛⎜ v 1 + v 2 + K + v N = 2 N 2 ⎜⎝ N ν = const , газ идеальный 15,9994 Кислород смеси Средняя кинетическая энергия поступательного движения молекул пост k О М ≈ 16⋅10-3 кг/моль Парциальное давление первого из газов, входящих в смесь, — т. е. давление, которое создавал бы этот газ, если бы он один занимал весь объем смеси. ν RT 3. Основное уравнение МКТ E kпост = m RT M разделим обе части на V: p= Абсолютная температура T = (t oC + 273)К р V T p(T ) = р V p1 p2 > p1 V р νR ⋅T p νR ⋅T V V1 < V2 T V V2 T T