N Жидкость Ж. +А
реклама
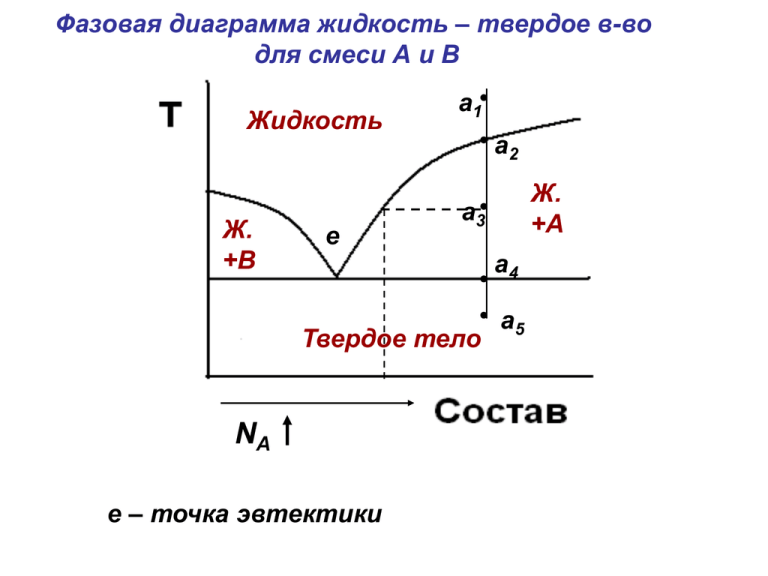
Фазовая диаграмма жидкость – твердое в-во для смеси А и В Жидкость Ж. +В е а1 а2 а3 Твердое тело NА е – точка эвтектики Ж. +А а4 а5 Химическая кинетика и катализ Предмет изучения: скорость и механизм протекания химических процессов в различных средах при различных условиях Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени dC dt моль/(л×с) C2 C1 C t t2 t1 0 концентрация 8 исходные продукты 4 0 0 2 4 6 8 время dCпрод dt dCисх dt Основной постулат: скорость химической реакции пропорциональна концентрации реагирующих веществ, взятых в некоторых степенях dC к С dt к – константа скорости химической реакции С – концентрация исходных веществ А В С D к С A CB Элементарные реакции. Молекулярность Элементарные реакции – это реакции, протекающие в одну стадию, без образования промежуточных продуктов Молекулярность – число молекул, участвующих в элементарной реакции. Мономолекулярные реакции: М I M II Бимолекулярные реакции: H 2 I 2 2 HI Тримолекулярные реакции: 2NO H 2 N 2O H 2O Порядок реакции Порядок реакции по веществу – это показатель степени при концентрации вещества в уравнение для скорости реакции Общий порядок реакции – это сумма порядков по каждому веществу, вступающему в реакцию АM к СA aА bВ cС dD к С C a A b B Порядок реакции = a b Кинетика необратимой реакции I-ого порядка АM dC к СA dt dC к t CA lnC kt const размерность к: с-1 ln C0 const С0 – начальная концентрация веществ (t=0) ln C ln C0 kt lnC ln C ln C0 kt 6 - tgα = k lnС0 4 α 2 0 -2 0 1 2 3 t 4 Кинетика необратимой реакции II-ого порядка А В С D к С A CB к С 2 размерность к: л/(моль×с) С A CB dC 2 к С dt 1 кt const C 1 const C0 1 1 кt C C0 1/C tgα = k 8 α 6 4 t 2 -1 0 1 2 3 4 Время полупревращения t1/2 – время, за которое прореагирует половина начального количества исходного вещества Реакции I-ого порядка: C ln k t1/ 2 C0 C 0,5C0 C0 ln k t1/ 2 0,5C0 t1/ 2 ln 2 k Реакции II-ого порядка: 1 1 к t1/ 2 C C0 1 1 к t1/ 2 0,5C0 C0 t1/ 2 1 к C0 Типы химических реакций • Последовательные А В С К1 • Параллельные К2 К1 В К2 С А • Обратимые А К1 К2 В 1 2 к1 С A к2 CB Влияние температуры на скорость химической реакции • Правило Вант-Гоффа kT2 kT1 T2 T1 10 kT 10 24 kT • Уравнение Аррениуса A ln k B T B ln k0 Ea ln k ln k0 RT Ea A R k k0 e Ea RT lnk Ea ln k ln k0 RT 6 lnk0 - tgα = Ea/R 4 α 2 0 -2 0 1 2 3 T 4 потенциальная энергия Еа исходные продукты Механизм реакции Бимолекулярные реакции • Емол< Ea • Емол> Ea Мономолекулярные реакции АB Теория Линдемана k1 А A A A А* - активированная молекула А А B k2 А A2A







