1 МОДУЛЬ 3 Галогенпроизводные
реклама
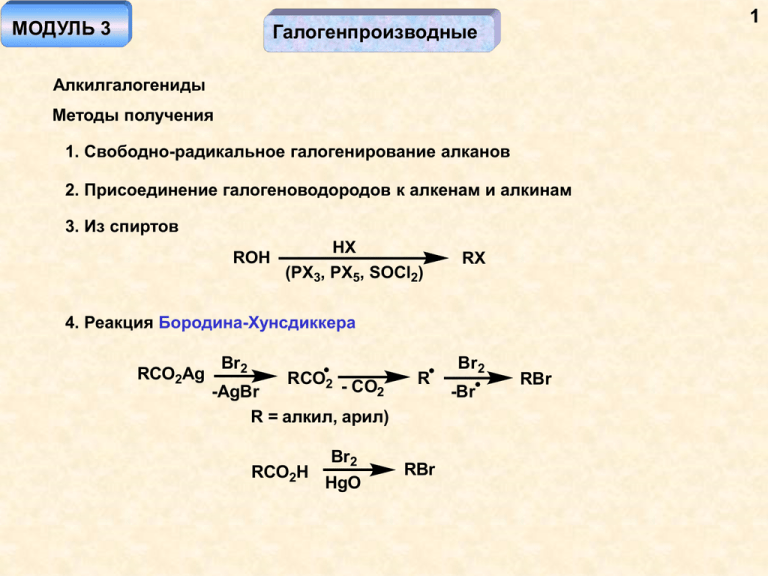
МОДУЛЬ 3 1 Галогенпроизводные Алкилгалогениды Методы получения 1. Свободно-радикальное галогенирование алканов 2. Присоединение галогеноводородов к алкенам и алкинам 3. Из спиртов ROH HX (PX3, PX5, SOCl2) RX 4. Реакция Бородина-Хунсдиккера RCO2Ag Br2 RCO2 - CO 2 -AgBr R = алкил, арил) RCO2H Br2 HgO R RBr Br2 -Br RBr 2 Реакции нуклеофильного замещения Бимолекулярное нуклеофильное замещение (SN2) RX + Nu- E RNu + X- переходное состояние скорость реакции V = k[RX][Nu-] обращение конфигурации * NaI * ацетон I S-изомер Cl R-изомер Nu- + C X Nu X Nu - -X переходное состояние 3 Факторы, влияющие на скорость реакции 1. Строение скелета Скорость реакции алкилгалогенидов изменяется в следующем ряду: первичные > вторичные. Третичные в реакцию по этому механизму не вступают (стерический фактор). Х хотя алкилгалогенид и первичный, он малореакционноспособен (стерические затруднения у -углеродного атома Бензилгалогениды и аллилгалогениды очень активны в реакции (стабилизация переходного состояния). Nu X Nu- X Гетероатомные заместители у того же атома углерода, что и уходящая группа, увеличивают частичный положительный заряд на этом атоме углерода, усиливая электростатическое притягивание нуклеофила к нему. Y X + Анхимерное содействие X Y Y - -X быстропротекающее внутримолекулярное SN2-замещение Nu- Nu Y быстропротекающее межмолекулярное SN2-замещение Cl S RN(CH2CH2 Cl)2 иприт Cl азотистые иприты (цитостатики, ОВ) 4 5 2. Растворитель а. Скорость реакции пропорциональна концентрациям реагентов (они должны растворяться в подходящем растворителе) б. Полярные исходные (нуклеофил) и конечные продукты (уходящая группа) и малополярное переходное состояние – в полярных растворителях (особенно протонных) хорошо сольватируются исходные и конечные, но мало сольватировано переходное состояние, что повышает энергию активации и снижает скорость реакции E E2 E1 S более полярный растворитель E2 > E1 O O ДМСО H O N ДМФА ацетон 6 RX-H S O S H-XR RX-H O O Nu- S M+ RX-H H-XR O RX-H O S сольватация нуклеофила протонными растворителями O S S сольватация катиона апротонным диполярным растворителем в. Природа нуклеофила Нуклеофил = основание, но основность и нуклеофильность могут не совпадать! Nu- + H+ - Nu + NuH + C X положение равновесия, определяемое основностью (основность - термодинамическая характеристика) -X- C Nu нуклеофильность - параметр, определяющий скорость реакции (кинетическая характеристика) 7 кислотность: HI > HBr > HCl > HF Причина - большая устойчивость большего по размеру аниона основность - F- > Cl- > Br- > Iсила нуклеофила в протонном растворителе: I- > Br- > Cl- > FПричина - увеличение эффективности сольватации, приводящей к делокализации заряда с уменьшением размера аниона сила нуклеофила в апротонном растворителе: F- > Cl- > Br- > IПричина - отсутствие сольватации аниона приводит к увеличению плотности заряда на анионе с уменьшением его размера Депротонированная форма является более сильным нуклеофилом, чем протонированная H2O более слабый нуклеофил, чем HOROH более слабый нуклеофил, чем RONH3 более слабый нуклеофил, чем NH2- Сила нуклеофила увеличивается с его поляризуемостью (с увеличением размера атома нуклеофильного центра RO- более слабый нуклеофил, чем RS- 8 г. Природа уходящей группы Уходящая группа является тем более «хорошей», чем она лучше поляризуема и лучше сольватируется, то есть, чем более слабым основанием она является. H2O >> HO- I- > Br- > Cl- > F- Превращение «плохой» уходящей группы в «хорошую» хорошая уходящая группа p-TsCl - OTs R X - p-TsO- RCH2X ClO2S пара-толуолсульфохлорид (хлористый тозил) p-TsCl HX - X R OH плохая уходящая группа - R OH2 X RCH2X - H2O хорошая уходящая группа p-TsO- - аналог сульфат-аниона очень слабое основание R-O-SO2R1 очень хорошая уходящая группа Nu-OSO2R1 RNu R1 = CF3, OR диметилсульфат - очень эффективный метилирующий реагент Nu- + (CH3O)2 SO2 CH3Nu Некоторые синтезы с использованием SN2-замещения: RCN H3O+ RCO2H CNRX C- R' -X- R SN2: R - первичный лучше вторичного X - I > Br > Cl R' растворитель апротонный диполярный - жидкий аммиак NO2RONO + RNO2 нитрит нитросоединение (в ДМФА, ДМСО основной продукт) N O O- нитрит-ион 9 Мономолекулярное нуклеофильное замещение SN1 RX + Nu- RNu + X- 10 лимитирующая стадия скорость реакции V = k[RX] рацемизация * OH R-изомер HBr карбокатион t Br рацемат Механизм реакции: Nu RX R+ RNu -X Факторы, влияющие на скорость реакции 1. Строение скелета Скорость реакции определяется устойчивостью карбокатиона и изменяется в следующем ряду: третичные > вторичные. Первичные в реакцию по этому механизму не вступают (первичные карбокатионы неустойчивы). 11 Аллильные и бензильные катионы очень устойчивы – аллил- и бензилгалогениды активны в реакциях мономолекулярного замещения. Субстраты, содержащие гетероатомный заместитель у атома углерода, связанного с уходящей группой, обладают высокой активностью (резонансно-стабилизированный катион) X Br X X -BrУчет пространственного строения молекулы Nu- X Nu Образование карбокатиона – возможность перегруппировок! X NuNu SN2 единственный продукт реакции SN1 Nu основной продукт реакции SN1 X- HX OH OH2 X 2. Растворитель На лимитирующей стадии происходит распад связи углерод-уходящая группа (полярное переходное состояние, необходимость сольватации уходящей группы). Сольватация нуклеофила некритична, он участвует на нелимитирующей стадии. 12 13 переходное состояние H-Solv RX + R X H-Solv H-Solv апротонный растворитель протонный растворитель R+solv.+ X-solv. карбокатион переходное состояние 3. Природа уходящей группы имеет значение, так как связь с ней рвется на лимитирующей стадии. Чем ниже основность, тем лучше уходящая группа. 4. Природа нуклеофила значения не имеет – взаимодействие его с карбокатионом происходит на нелимитирующей стадии. 14 Механизм SNi Cl SOCl2 бензол * OH H O R-изомер Cl -SO2 -HCl * Cl R-изомер O реакция происходит в "клетке" растворителя (бензола) с сохранением конфигурации асимметрического центра. В случае использования в качестве избытка SOCl2, происходит частичная рацемизация Реакции элиминирования Топология R A R R B -AB R 1,1-элиминирование (-элиминирование) карбен пример: CHCl3 HO-H2O CCl3 -Cl- CCl2 X 15 Y 1,2-элиминирование (-элиминирование) -XY Cl примеры: Br Br Na Cl Zn EtO- H Cl 1,3-элиминирование ( -элиминирование) X Y -XY -элиминирование Бимолекулярный механизм -элиминирования E2 E2 Nu- NuX + возможные направления + H + атаки CH H CH C H2 Направление атаки управляется основностью нуклеофила – Nu SN2 высокая основность благоприятствует элиминированию 16 17 Cl EtO- > > по правилу Зайцева Конформационный анализ позволяет определить основное направление реакции: конформации, в которых может происходить реакция Cl Cl H3C H H3C H3C H Cl H < < H H CH3 более H устойчивая конформация 18 Br H H > (H3C)3C эта реакция идет быстрее! H H Br правило Зайцева цис -изомер (основной конформер) благоприятная для реакции конформация H Br H H H Br H (H3C)3 C H H H транс-изомер (основной конформер) нереакционная конформация C(CH3)3 транс -изомер единственный (минорный конформер) продукт реакционная конформация 19 Реакция Гофмана (элиминирование) Связь С-Н рвется несколько быстрее, чем связь С-N, поэтому атом углерода, от которого отщепляется протон, приобретает карбанионный характер. Поскольку алкильные заместители являются донорами электронов, первичный карбанион стабильнее вторичного, что и определяет направление реакции. N N H2C H C t H H E2 HO- H2C H C H H HO переходное состояние -N(CH3)3 - H2O продукт по правилу Гофмана 20 Мономолекулярный механизм элиминирования E1 лимитирующая стадия Cl -Cl - H+ - E1 Nuкарбокатион Nu SN1 скорость реакции V = k[субстрат] Для реализации этого механизма необходима устойчивость образующегося карбокатиона, требуется хорошая уходящая группа, способствует повышенная температура, и нужна малонуклеофильная среда (конкуренция с мономолекулярным SN1 замещением) E1 H2SO4 OH HCl или HClO4 t Cl- - сильный нуклеофил, HSO4- - слабый Cl SN1 21 Образование карбокатиона означает возможность перегруппировок Стереохимия процесса (конформационный анализ): Cl (CH3)3COK t E1 > конформации, в которых может происходить отщепление протона (связь С-Н должна быть параллельна вакантной орбитали H H H3C H H CH3 CH3 H H CH3 CH3 H из этих конформаций образуется цис -изомер H H3C CH3 H H CH3 H H более устойчивые конформации (их содержание выше), из них образуется транс-изомер 22 1 3 2 Cl -Cl- -H+ не образуется Связь С2-С1 Связь С2-С3 H H3C H C(CH3)3 CH3 H CH3 (H3C)3C H H очень неустойчивая конформация устойчивая конформация (образуется менее замещенный алкен) Механизм Е1cb Первая стадия – отрыв протона. Обычно происходит в случае, когда протон присоединен к гетероатому. O X H Nu- O O -HNu первая стадия - лимитирующая X анион - X- 23 X XH Nu E1 H E2 X H+ E1cb Комментарии: Реакции Е2 и SN2 являются конкурирующими – повышение силы основания и температуры приводит к увеличению доли элиминирования Реакции Е1 и SN1 являются конкурирующими – элиминированию способствует ненуклеофильная среда и повышение температуры Увеличение полярности растворителя в большей степени ускоряет реакцию Замещения по типу SN2 по сравнению с Е2 Чем лучше уходящая группа, тем в большей степени элиминирование Е1 превалирует над Е2 24 Син-элиминирование O O направление реакции статистическое (пропорционально количеству протонов у -углеродного атома H - CH CO H 3 2 SCH3 Реакция Чугаева OH CS2 O CS2- O CH3I S H - HO ксантогенат Элиминирование по Коупу N(CH3)2 H2O2 N+ OH оксид амина _ N OH 25 Винилгалогениды Синтез R X H R R HX X радикальное или электрофильное присоединение R Бимолекулярное нуклеофильное замещение (SN2) невозможно - атака в плоскости молекулы пространственно затруднена NuX H Замещение по типу SN1 и элиминирование Е1 невозможно по причине неустойчивости винильного катиона H -X- вакантная sp 2-гибридная орбиталь вакантная р-орбиталь 120o R R sp2 sp 26 X - Бимолекулярное элиминирование E2 возможно, но протекает в более жестких условиях, чем в случае алкилгалогенидов -NuH -X- H Nu Присоединение-отщепление R R Nu- Nu X R -X- X Nu R должен быть сильным акцептором! Например: O - Nu X винилог галогенангидрида O Nu O X устойчивый карбанион O Nu X -X- Nu 27 Арилгалогениды Методы получения 1. Ароматическое электрофильное замещение 2. Реакция Бородина-Хунсдиккера PhH Br2 Fe PhBr Br2 PhCO2Ag 3. Превращение солей диазония ArX HX ArNH2 NaNO2 H3O+, 0o Х = Br, Cl (реакция Зандмейера) CuX ArN2+ HBF4 ArN2+BF4- t ArF реакция Больца-Шимана NaI ArI 28 Нуклеофильное замещение X SN1 SN2 SN2 - невозможно (стереоэлектронный контроль), SN1 - невозможно (неустойчивый фенильный катион) PhCl H2O/NaOH 340o PhOH O- Cl H2O/NaOH O2N PhO- 180o O2N O- Cl 29 H2O/Na2CO3 O2N NO2 100o O2N NO2 NO2 NO2 O- Cl H2O 100o O2N O2N NO2 NO2 Механизм реакции: Ароматическое нуклеофильное замещение SNAr X + C Nu- X Nu X Nu X Nu Nu -X- R R R R анионный -комплекс (комплекс Мезенгеймера) акцепторные заместители в орто-пара-положениях стабилизируют R 30 лимитирующая стадия X Nu X Nu -комплекс NO2 N O O резонансная стабилизация -комплекса нитрогруппой (-М-эффект) как правито, лимитирующая стадия - образование -комплекса Следовательно, ряд активности арилгалогенидов: PhF > PhCl > PhBr > PhI X Cu+ Nu-CuX PhNu реакция катализируется солями меди, и в этом случае реакционная способность меняется в следующем ряду: I >> Br >Cl > F 31 PhOH HO- Cu+, 300o CuCN t PhCN 2 PhI Cu PhI R Ph-Ph C-Cu пиридин PhCl PhONa Cu+, 250o PhOPh Ульман R Ph Ходкевич-Кадьо Аринный механизм (отщепление - присоединение) Cl NH2 * * NaNH2 t NH2 + 1:1 * 32 Cl KOH, 340o -H+, -Cl- Nu Nu- + Nu дегидробензол (бензин, арин) Nu < ароматическое и очень неустойчивое соединение Nu Применение галогенпроизводных: CH2Cl2 - хлористый метилен CHCl3 - хлороформ CCl4 - четыреххлористый углерод CH2 ClCH2Cl - дихлорэтан растворители Джеймс Янг Симпсон – изобретатель наркоза хлороформом Фреоны - фторхлоруглероды (CF2Cl2, CFCl3, C2F2Cl3 - хладагенты, пропелленты Тетрафторэтилен – мономер для получения тефлона Cl Инсектициды Cl Cl Cl2 PhH h Cl Cl Cl гексахлоран CCl3 Cl ДДТ Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl гептахлор (дильдрин) Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl альдрин 33 34 Гербициды Cl O O N N H монурон N Cl N H Cl диурон Cl O-Na+ O Cl CO2H Cl Cl Cl Cl Cl Cl H3CO2C CO2CH3 Cl Cl дактал Cl 2,4-D O-Na+ O Cl ClCH2CO2-Na+ Cl O Cl Cl O Cl + Cl Cl 2,4-D Cl CO2H тетрахлордибензодиоксан (диоксин) 35 Перфтордекалин – кровезаменитель («голубая кровь») F2C F2C F2 C CF F2 C CF C F2 C F2 CF2 CF2 36 Металлоорганические соединения Магнийорганические соединения Синтез Mg RX RMgX реагент Гриньяра растворитель (безводный!): диэтиловый эфир, тетрагидрофуран (ТГФ) R = алкил, арил Х = I > Br > Cl X Mg MgX ТГФ Норман Переметаллирование R' CH RMgX -RH R' CMgX RMgX -RH + MgX Йоцич Виктор Гриньяр Нобелевская премия, 1912 г. Cl (CH2)n MgCl Mg n 4 (CH2)n Cl Br Mg 37 Br C2H4 Br MgBr MgBr Br -MgBr2 MgCl Br Mg Mg BrMg Br Br Свойства реактивов Гриньяра + RH2C MgX RH H+ RMgX атом углерода - основный и нуклеофильный центр R'X RR' -MgX2 бимолекулярное нуклеофильное замещение SN2 побочный процесс в синтезе реактива Гриньяра! Препаративное значение имеет в случае, когда активность в реакции замещения галогенпроизводного RX >> R'X, H+ = вода, карбоновые кислоты, спирты, амины (любой Х-Н) 38 Например: Br C4H9 С4H9MgBr PhMgBr CH3I PhCH3 Нуклеофильное раскрытие эпоксидного цикла O + O Ph OMgX R MgX S 2 N H2O OH R R R RMgX SN2 OMgX R H2O Ph пространственная доступность OH Ph бензильное положение Нуклеофильное присоединение по полярным кратным связям R Z Z - + R MgX Mg Z - + X R MgX эектрофильный катализ нуклеофильного присоединения Mg Z R X 39 Карбонильные соединения CH2O 1. RMgX 2. H2O 1. RMgX R'CHO 2. H2O первичные спирты RCH2OH HO 1. R'MgX R'CHO 2. H2O R' R O вторичные спирты R 1. R"MgX O OH 1. RMgX R" R' R' 2. H2O R" 2. H2 O R R' третичные спирты 1. R'MgX O 2. H2O R" R 40 Производные карбоновых кислот R' O R'MgX R R OEt O O- OEt E1cb медленно R OMgX R'MgX R' R OH H2 O R' R R' быстро R' продукт реакции! Исключение: O 1. MgCl H - 40o, обратный порядок прибавления CHO OEt 2. H2 O R' RCO2H R'MgX -R'H RCO2-MgX+ R' R'MgX O- R O H2O Oэлиминирование невозможно - нет хорошей уходящей группы! R R' 41 + R NMgX R'MgX N R CO2 RMgX NH H2O R' R O H3O+ R R' R' O RCO2-MgX+ 1.RMgX 2. H3O+ H3O+ R R RCO2H RMgX O2 RMgX Cl (ýô èð) SN2 R-R I2 RMgX ROH 1. O2 Mg SN1 OH ROMgX ROOMgX H2O MgCl 2. H2O 1. S8 2. H2O RSH OH 42 Литийорганические соединения Синтез Li RLi расторитель безводный, эфир, ТГФ, алканы -LiX RX R Li очень полярная связь - сильный нуклеофил и сильное основание t > -40o O Et H Li C(CH3)3 -EtOLi -(CH3)3CH CH2CH2 2. Металлирование N H3CO OCH3 N Li RLi RLi -RH -RH Li 43 Свойства Полная аналогия с реактивами Гриньяра, большая реакционная способность Диалкилкупраты лития R-R' R'X RLi CuX R' = алкил, винил R2CuLi R'COCl O RMgX CdX2 R2Cd R'COCl R R'