Урок на тему:
реклама

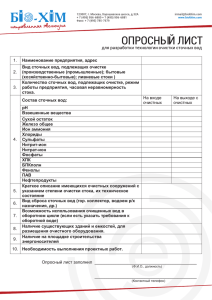
Урок на тему: Цели урока. Сформировать представление о составе природных вод и способах их обработки перед употреблением. Отработать навыки написания уравнений реакций, лежащих в основе устранения временной и постоянной жесткости воды. Сформулировать представление об источниках загрязнения природных вод и методах очистки сточных вод. Оборудование. Таблицы и схемы: «Состав природных вод», «Способы устранения временной и постоянной жесткости пресной воды», «Очистка воды». Основные вопросы. 1. Каковы важнейшие свойства воды, в чем ее уникальность?(презентация ученика) 2. Каковы причины изменения среды водных растворов? 3. Какими способами устраняют все виды жесткости воды? 4. Какую обработку проходит вода, прежде чем дойдет до потребителя? (сообщение ученика) 5. Как обезвреживают сточные воды? 6. Блиц-опрос Содержание урока. Природные воды. Питьевая вода. Загрязнение воды. Очистка сточных вод. Лабораторные опыты. Ход урока. Загадка: Я очень добродушная, Я мягкая, послушная, Но когда я захочу Даже камень источу. На экране компьютера появляются слова: - Вода – одно из начал всего существующего на Земле. - Вода простое вещество, единое и неделимое. - Вода дороже золота, утверждали бедуины, всю жизнь кочевавшие в песках Содержание урока. Природные воды. Питьевая вода. Загрязнение воды. Очистка сточных вод. Лабораторные опыты Сравните состав морской и пресной воды по катионам и анионам. Напишите химические формулы солей, содержание которых в этих водах наибольшее. Составьте схему поэтапной очистки природных вод предназначенных для питья Какие вещества, загрязняющие природные воды, считаются наиболее опасными для человека? Лабораторные опыты ( Какие качественные реакции используются для обнаружения катионов железа (2), хлорид-ионов, сульфатионов. Допишите молекулярные уравнения реакций обнаружения катионов железа (2), хлорид-ионов, сульфат- ионов 1.FeCl3 + KNCS = Fe(NCS)3 +….. 2 CaCl2 + Na2CO3 =… 3 NaCl + AgNO3 =…. 4 Na2SO4 + BaCl2 =… Какие методы используют для очистки жидкостей? Составьте уравнения реакций образования в природе: а) гидрокарбоната кальция из карбоната кальция, б) карбоната кальция из гидрокарбоната кальция. Допишите уравнения реакций. На что они указывают? Mg(HCO3)2 + Na2CO3 =…. Mg(HCO3)2(кипячение) =…. Mg(HCO3)2 + Ca(OH)2 =….. MgSO4 + Na2CO3 =… MgCl2 + Na2CO3 =…. CaSO4 + Na2CO3 =….. CaSO4 + Na3PO4 =…. Ca(HCO3)2 + Na2CO3 =….. Ca(HCO3)2 + Ca(OH)2 =….. Ca(HCO3)2(кипячение) =…… Примерные вопросы и задания для самостоятельной работы Ответьте на вопросы блиц-опроса «Проверь себя» словами «да» или «нет» 1. Водопроводная вода – это чистое вещество? 2. Катионы натрия придают жесткость воде? 3. Можно ли избавиться от постоянной жесткости воды кипячением? 4. Можно ли отделить масло от воды. Если можно то как? 5. Отделяются ли нерастворимые в воде примеси с помощью бумажного фильтра? 6. Можно ли использовать для очистки метод дистилляции? 7. Применяется ли дистиллированная вода в химической лаборатории и в аптеке? 8. Можно ли обнаружить хлорид-ионы в воде? 9. Можно ли обнаружить в воде катионы кальция с помощью карбонат-ионов? Домашнее задание 1. Выполните творческое задание Представьте схемы: а) круговорота воды в природе, б) факторы, определяющие качество воды, в) способы очистки сточных вод) 2.Выполните дома практическую работы:: «Анализ качества водопроводной воды» Цель работы: дать характеристику качества водопроводной воды . Ход работы 1. Определите цвет воды. Для этого опустите в стакан с водой белую пластинку или лист белой бумаги. Цвет воды, может быть: Цвет « Да » - « Нет » бурый Светло-коричневый желтый Светло-желтый зеленоватый бесцветный 2. Определите запах воды и его интенсивность. Запах воды, может быть: Запах Интенсивность запаха: ( нет, слабая, очень сильная, отчетливая) болотный глинистый древесный плесневый травянистый сероводородный другие запахи 3. Определите вкус воды. Вода может быть: А) соленая Б) горькая В) кислая Г) с хлорным Д) с металлическим или иным привкусом Е) безвкусная или с приятным для питья вкусом 4. Выводы. Питьевая вода не должна быть?