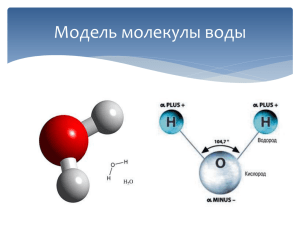
УГЛЕРОД 1. Углерод образует два оксида – оксид углерода (II) и оксид углерода (IV). Напишите формулы данных оксидов и укажите их тривиальные названия. (СО угарный газ, СО2 углекислый газ) 2. Что произойдет, если человек вдохнет воздух содержащий 0,1 % оксида углерода (II)? (потерять сознание и умереть) 3. Известно, что оксид углерода (II) хороший восстановитель. В чем проявляются эти свойства и как его используют в металлургии. (восстановитель - значит способен отдавать электроны, оксид углерода (II) способен отнимать кислород у оксидов металлов, т.е. восстанавливать металлы из их оксидов Fe+32O3 + 3C+2O = t = 2Fe0 + 3C+4O2↑) 4. При давлении примерно 60атм оксид углерода (IV) превращается в бесцветную жидкость, при испарении жидкого газа часть его превращается в твердую снегообразную массу. Что это за вещество и для чего его применяют? («сухой лед» - для хранения пищевых продуктов). 5. В промышленности углекислый газ получают обжигом известняка. Напишите уравнение реакции и скажите производство какого продукта служит основной целью данной реакции. (CaCO3 =t= CaO + CO2↑ с целью получения гашенной извести СаО) 6. Будучи двухосновной, угольная кислота образует два ряда солей, какие? (средние – карбонаты, например СаСО3, и кислые – гидрокарбонаты, например Са(НСО3)2). Жесткость воды Прочитайте текст и выполните задания. Значительные количества растворимых солей кальция и магния в воде обусловливают жесткость воды. Дождевые осадки, попадая на поверхность и протекая в недрах Земли, соприкасаются с минералами кальция и магния (это в основном карбонаты), вымывают из них мелкие частички. В воде, насыщенной углекислотой, нерастворимые карбонаты кальция и магния превращаются в растворимые гидрокарбонаты (кислые соли) _______________, ______________. В таком растворимом виде гидрокарбонаты металлов остаются в воде и обусловливают ее временную (или карбонатную) жесткость. Кроме временной жесткости, существует еще так называемая постоянная (или некарбонатная) жесткость, обусловленная присутствием в природной воде хлоридов, сульфатов кальция и магния. А вместе временная и постоянная жесткость составляют общую жесткость воды. Жёсткая вода не подходит для приготовления пищи, в ней плохо завариваются чай, кофе, постоянное употребление жёсткой воды может привести к отложению солей (мочекаменная болезнь) в организме человека. Жёсткая вода непригодна для многих технических целей: из-за образования накипи она непригодна для использования в паровых котлах, металлических конструкций, трубопроводах. В жесткой воде плохо мылится мыло и возрастает его расход. Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении. Приведённые примеры указывают на необходимость удаления из воды солей кальция и магния. При кипячении воды гидрокарбонаты разлагаются и выпадают в осадок. Выпадающие в осадок карбонаты и есть накипь на стенках водонагревательных приборов и охладительных систем. Из воды временную жесткость можно удалить не только с помощью кипячения, но и добавлением известковой воды – раствора гидроксида кальция _______________. Постоянную жесткость нельзя устранить кипячением. Для умягчения воды в этом случае используют соду – карбонат натрия _______________. В результате реакций обмена в осадок будут выпадать нерастворимые карбонаты кальция и магния. Иногда вместо соды используют фосфат натрия, который с катионами кальция и магния тоже образует нерастворимые соединения. Задание: 1. Найдите в тексте признаки химических реакций и подчеркните их. 2. На месте пропусков укажите формулы веществ, о которых говорится в тексте. 3. Рассчитайте молярную массу двух веществ: кислой и средней соли. 4. Рассчитайте массовую долю углерода в составе каждого из двух веществ. 5. Составьте уравнения химических реакций, описанных в тексте. 1. нерастворимые карбонаты кальция и магния превращаются в растворимые гидрокарбонаты, выпадают в осадок. 2. Mg (HCO3)2 , Ca (HCO3)2 , Ca (OH)2 , Na2 CO3. 3. кислые соли М (Mg (HCO3)2)=146 г/моль, М (Ca (HCO3)2)=162 г/моль, средние соли М (Ca (OH)2)=74 г/моль , М (Na2 CO3)=106 г/моль. 4. ω (C) Mg (HCO3)2=8,2 % , ω (C) Ca (HCO3)2=7,4 %, ω (C) Ca (OH)2=16,2 %, ω (C) Na2 CO3=11,3 % 5. уравнения 1. Ca CO3 + СО2 + Н2О → Ca (HCO3)2 2. Mg CO3 + СО2 + Н2О → Mg (HCO3)2 3. Ca (HCO3)2 → CaCO3 + СО2 + Н2О 4. Mg (HCO3)2 → MgCO3 + СО2 + Н2О 5. Ca (HCO3)2 + Ca (OH)2 → 2 Ca CO3 ↓ + H2O 6. Mg (HCO3)2 + 2 Ca (OH)2 → Mg (OH)2 ↓ + 2 Ca CO3 ↓ + 2 H2O 7. Ca (HCO3)2 + Na2CO3 → Ca CO3 ↓ + 2 Na HCO3 8. Mg (HCO3)2 + Na2 CO3 → Mg CO3 ↓ + 2 Na HCO3


![ионнaя сила c [m m ol/l] p H μr>μ Физико](http://s1.studylib.ru/store/data/002536317_1-d3dcf21869af3ad9327d8f7749f7c309-300x300.png)