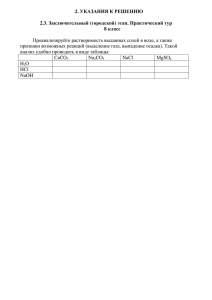
Жидкие и твёрдые вещества Жидкость Жидкость – это одно из агрегатных состояний вещества. Основным свойством жидкости, отличающим её от других агрегатных состояний, является способность неограниченно менять форму под действием механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём. Свойства жидких веществ 1. Молекулы находятся близко друг к другу, поэтому жидкости – малосжимаемы, в отличие от газов. 2. Текучи, то есть не имеют собственной формы; 3. В состоянии невесомости принимают форму шара или круглой капли. Свойства жидких кристаллов 1. Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). 2. Молекул жидких кристаллов имеют сильно вытянутую линейную форму. 3. Они обладают сравнительно упорядоченным расположением молекул. Свойства воды 1. Самое уникальное вещество на нашей планете – это вода. 2. Животные, растения, человек на 70-80% состоят из воды. 3. Все реакции обмена веществ в организме человека – это реакции гидролиза. 4. Без воды невозможно существование биосферы, потому что круговорот веществ и энергии возможен с участием воды. Свойства воды 5. В жидком состоянии при 4°С плотность воды максимальная и равна 1 г/см3, а в твердом состоянии (лёд) плотность при -2°С равна 0,92 г/ см3 6. В жидком состоянии в молекуле воды возникает ковалентная полярная связь, а между молекулами воды – водородная. У льда химическая связь – ковалентная полярная. 7. Тип кристаллической решетки воды и в жидком и твердом состоянии (лёд) – молекулярная. Круговорот воды Переход жидкостей из одного состояния в другое 1. Испарение – это постепенный переход вещества из жидкости в газообразную фазу (пар). 2. Конденсация – это обратный процесс, переход вещества из газообразного состояния в жидкое. 3. Кипение – это процесс парообразования внутри жидкости. 4. Сублимация – это непосредственный переход при нагревании твердого вещества в газообразное, минуя стадию жидкости. 5. Смешиваемость – это способность жидкостей растворяться друг в друге. Жесткость воды Жёсткость воды – это совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Различают два вида жесткости: 1. Временная – обусловлена содержанием в воде гидрокарбонатов кальция, магния, железа; 2. Постоянная – обусловлена содержанием других солей (хлоридов, сульфатов). Виды жесткости воды Общая жесткость воды Постоянная (некарбонатная) Временная (карбонатная) CaCl2, CaSO4, MgCl2, MgSO4. Ca(HCO3)2 Mg(HCO3)2 Природная вода Природная вода Жесткая Мягкая Вода с большим содержанием солей щелочноземельных металлов (Ca и Mg). Вода с малым содержанием солей щелочноземельных металлов (Ca и Mg). Примеры жесткой и мягкой воды 1. Самая жесткая вода – морская, содержание солей в ней 35 г/л; 2. Самая мягкая – дождевая и талая; 3. Самая мягкая, но искусственная – дистиллированная 4. Минеральная вода: А) катионы – Na+, K+, Ca2+, Mg2+, Б) анионы – SO42-, Cl-, HCO3- Жёсткая вода I. Непригодна: 1. Для питания паровых котлов; 2. Для применения в химической технологии; 3. В производстве керамике, бетонных смесей; 4. Приводит к нарушению работ теплосетей. II. В жесткой воде: 1. Мыло не образует пену; 2. Не заваривается чай; 3. Приводит к появлению камней в почках. 4. При умывании сушится кожа, поры закупориваются. Мягкая вода I. Приводит: 1. К коррозии труб; 2. Дефициту в организме ионов Ca2+ и Mg2+, что ослабит опорно-двигательный аппарат, нервную и сердечно-сосудистую систему, и даже может спровоцировать инфаркт. Вывод: потребление жёсткой или мягкой воды не является опасным для здоровья, высокая жёсткость способствует образованию мочевых камней, а низкая – незначительно увеличивает риск сердечно-сосудистых заболеваний. Способы устранения временной жесткости 1. Термический метод – кипячением воды При кипячении воды происходит разложение гидрокарбонатов кальция и магния с образованием углекислого газа и карбонатов этих металлов, которые выпадают в осадок: t°C Са(НСО3)2 → CаСО3↓ + СО2↑ + Н2О t°C Mg(HCO3)2 → MgCO3 ∙ H2O + СО2↑. Способы устранения временной жесткости 2. Химические методы: а) Известковый метод. Основан на обработке воды гашеной известью, при этом устраняется временная жесткость, а также связываются ионы Fe2+. Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О Mg(НСО3)2 + Са(ОН)2 → Mg(ОН)2↓ + 2СаСО3 + 2Н2О FeSO4 + Ca(OH)2 → Fe(OH)2↓ + CaSO4 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3↓ Способы устранения постоянной жесткости б) Фосфатный метод (устранение общей жесткости) Базируется на образовании нерастворимых ортофосфатов кальция и магния, выпадающих в осадок: 3CaSO4 + 2Na3PO4 = 3Na2SO4 + Ca3(PO4)2↓ 3MgCl2 + 2Na3PO4 = 6NaCl + Mg3(РO4)2 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3 3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3 Способы устранения постоянной жесткости в) Метод кальцинирования: Метод основан на использование кальцинированной соды (Na2CO3). При стирке позволяет экономить моющие средства, а отсутствие хлопьевидных осадков улучшает качество ручной и машинной стирки. MgSO4 + Na2CO3 → MgCO3↓ + Na2SO4 CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl Ионный вид: Ca2+ + CO32- → CaCO3↓ Способы устранения жесткости 3. Физико-химический метод (использование катионитов): В воду необходимо поместить ионообменную смолу. При соприкосновении с водой она поглощает катионы солей. Забирая их у кальция, магния, железа и марганца, она отдает ионы натрия и водорода, а вода становится мягкой. Na2R + Ca(HCO3)2 → 2NaHCO3 + CaR Na2R + CaCl2 → 2NaCl + CaR Твердые вещества Твёрдое тело – это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Свойства твердых веществ 1. Механические - упругость, твердость, способность к деформации. 2. Тепловые - температуры кипения и плавления, коэффициент теплового расширения. 3. Электрические и магнитные - проводимость тепловая и электрическая. Виды твердых веществ Твердые вещества Аморфные Кристаллические Отсутствие атомной или молекулярной кристаллических решеток Есть все типы кристаллических решеток Аморфные твердые вещества Аморфные вещества – это твердые вещества, которые не имеют кристаллической решетки, сохраняющие свою форму достаточно долго, но через длительное время форма тел изменяется под действие температуры. Примеры аморфных тел: Восковая свеча, шоколад, жевательная резинка, смола, стекло, затвердевшие смолы (янтарь), целлюлоза, полиэтилен, гели, клей, канифоль, пластилин. Аморфные вещества неустойчивые и рано или поздно переходят в кристаллические. Переход аморфных веществ в кристаллические А) аморфное стекло под влиянием ударных нагрузок образуются мелкие кристаллы, которые мутнеют. Б) Твердый мед, так же засахаривается с течением и при длительном хранении образуется стекловидная карамель. В) Пластическая сера S8 представляет собой аморфное вещество и через некоторое время превращается в кристаллическую (ромбическую) серу с молекулярной кристаллической решеткой. Аморфные и кристаллические вещества в одном веществе Некоторые вещества могут находиться и в кристаллическом, и в аморфном состояниях – например, сера, кремний, фосфор, оксиды (бора, кремния, фосфора) и тому подобные. Многие вещества могут быть переведены из аморфного состояния в кристаллическое и наоборот. Например: Sn(пластическая) → S8 (ромбическую). Кристаллические твердые вещества В атомной кристаллической решетке частицы твердого вещества связаны ковалентной связью. Она отличается своей прочностью. Такие вещества отличаются высокой tпл и tкип. Например: кварц (SiO2) и алмаз (C). В молекулярной кристаллической решетке связь между частицами отличается своей слабостью. Вещества такого типа характеризуются легкостью tзакип и tпл. Они отличаются летучестью, благодаря которой имеют определенный запах. Например: лед (H2Oтв), сахар (C6H12O6). В ионной кристаллической решетке в узлах чередуются соответствующие частицы, заряженные положительно и отрицательно. Они удерживаются электростатическим притяжением. Многие вещества этого вида легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавки. Например: соли (NaCl), щелочи (MeOH), основные оксиды (Me2O и MeO). В металлической кристаллической решетке в узлах присутствуют только ионы химических веществ, заряженные положительно. Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Например: металлы (кроме ртути). Лабораторная работа Тема: «Жесткость воды, способы ее устранения». Реактивы: жесткая вода (вода с добавлением хлоридов кальция и магния), мыльный раствор, раствор кальцинированной соды Na2CO3, раствор гашеной извести Ca(OH)2. Оборудование: пробирки, штатив для пробирок, держатель для пробирок, спиртовка, спички. Ход работы: 1. В чистую пробирку налейте 2 мл жесткой воды. Добавьте 1–2 мл мыльного раствора. Наблюдения? 2. В чистую пробирку налейте 3–4 мл жесткой воды. Добавьте 12 мл гашеной извести. Наблюдения? Допишите уравнение реакции, составьте полное и сокращенное ионные уравнения: MgCl2 + Ca(OH)2 → 3. В чистую пробирку налете 1–2 мл жесткой воды. Добавьте 1–2 мл раствора кальцинированной соды. Наблюдения? Допишите уравнение реакции, составьте полное и сокращенное ионные уравнения: CaCl2 + Na2CO3 → 4. В чистую пробирку налейте 3–4 мл жесткой воды. Прокипятите. Наблюдения? Запишите уравнение реакции разложения гидрокарбоната кальция. t°C Са(НСО3)2 → 5. Разделите прокипяченную воду на 2 пробирки. Добавьте в одну из пробирок раствор кальцинированной соды Na2CO3. Наблюдения? Налейте в обе пробирки по 1 мл мыльного раствора. Наблюдения? По результатам работы сделайте вывод, дописав предложения. Задание 1 Осуществите цепочки превращений: ЕГЭ. KOH → KO3 → O2 → K2O4 → KOH Во второй реакции расставить коэффициенты методом электронного баланса. ЕГЭ. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н. у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси. Решение задания №1 1) Цепочка: NaCl + H2O (e.t.) = NaOH + Cl2 + H2 NaOH (e.t.) = Na + H2O + O2 2Na + O2 = Na2O2 Na2O2 + 2Na = 2Na2O 2) Цепочка 4KOH + 4O3 = 4KO3 + O2 + 2H2O 2KO3 (t) = 2KO2 + O2 2O2 + 2K = K2O4 2K2O4 + 2H2O = 4KOH + 3O2 Решение задания №1 3) Цепочка: Na2O2 + H2O = NaOH + O2 NaOH + CO2 = NaHCO3 NaHCO3 (t) = Na2CO3 + H2O + CO2 Na2CO3 + Ba(OH)2 = NaOH + BaCO3 4) Цепочка: CaCO3 (t) = CaO + CO2 CaO + C (t) = CaC2 + CO CaC2 + H2O = Ca(OH)2 + C2H2 Ca(OH)2 + CO2 = Ca(HCO3)2 Решите задачи: 1-3 ряд. При обработке 10 г смеси алюминия и цинка избытком соляной кислоты выделилось 6,72 л газа (н. у). Вычислите массовую долю цинка и алюминия в смеси? 1 р. NaCl → NaOH → Na → Na2O2 → Na2O 2 р. Na2O2→ NaOH → NaHCO3 → Na2CO3→ NaOH 3 р. CaCO3→ CaO→ CaC2 → Ca(OH)2 → Ca(HCO3)2 Дано: m(Zn, Al, Cu) = 16 г V(газа) = 5,6 л m(остатка) = 5 г Найти: ω (Zn) - ? ω (Al) - ? ω (Cu) - ? Решение: 1) Zn + 2HCl => ZnCl2 + H2 ↑; 2Al + 6HCl => 2AlCl3 + 3H2 ↑; Cu + HCl = реакция протекать не будет; 2) m остатка = m (Cu) = 5 г;