Реакции ионного обмена
реклама
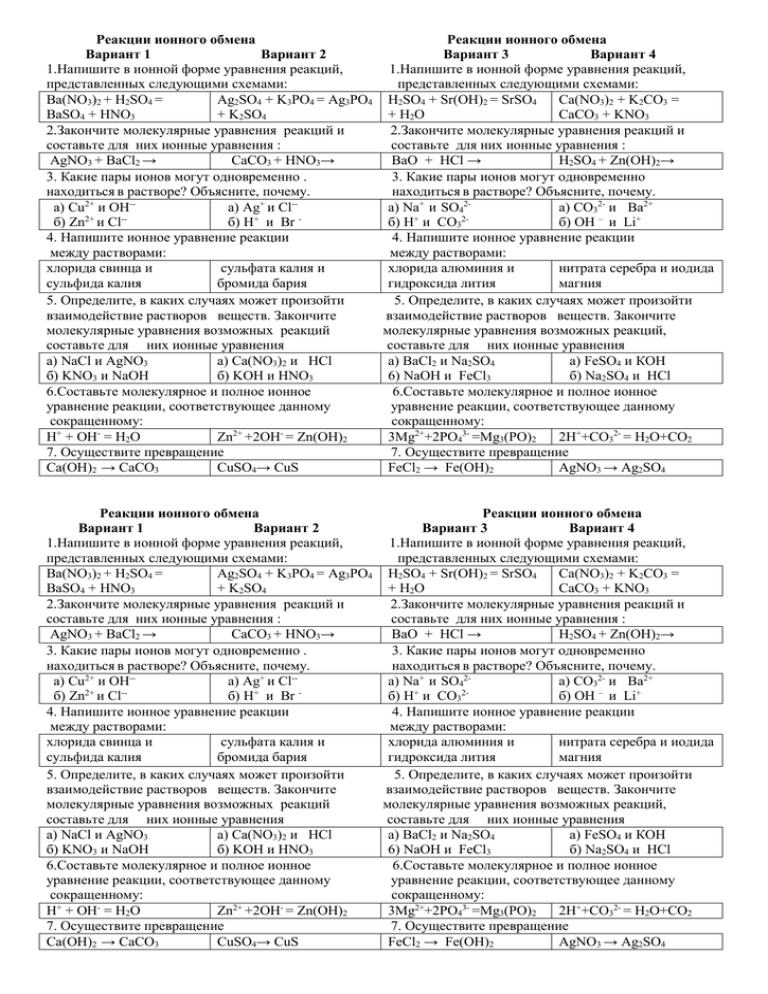
Реакции ионного обмена Реакции ионного обмена Вариант 1 Вариант 2 Вариант 3 Вариант 4 1.Напишите в ионной форме уравнения реакций, 1.Напишите в ионной форме уравнения реакций, представленных следующими схемами: представленных следующими схемами: Ba(NO3)2 + H2SO4 = Ag2SO4 + K3PO4 = Ag3PO4 H2SO4 + Sr(OH)2 = SrSO4 Ca(NO3)2 + K2CO3 = BaSO4 + HNO3 + K2SO4 + H2O CaCO3 + KNO3 2.Закончите молекулярные уравнения реакций и 2.Закончите молекулярные уравнения реакций и составьте для них ионные уравнения : составьте для них ионные уравнения : AgNO3 + BaCl2 → CaCO3 + НNO3→ BaО + HCl → H2SO4 + Zn(OH)2→ 3. Какие пары ионов могут одновременно . 3. Какие пары ионов могут одновременно находиться в растворе? Объясните, почему. находиться в растворе? Объясните, почему. а) Cu2+ и ОН-а) Ag+ и Cl-а) Na+ и SO42а) CO32- и Ba2+ 2+ -+ + 2б) Zn и Cl б) H и Br б) H и CO3 б) ОН – и Li+ 4. Напишите ионное уравнение реакции 4. Напишите ионное уравнение реакции между растворами: между растворами: хлорида свинца и сульфата калия и хлорида алюминия и нитрата серебра и иодида сульфида калия бромида бария гидроксида лития магния 5. Определите, в каких случаях может произойти 5. Определите, в каких случаях может произойти взаимодействие растворов веществ. Закончите взаимодействие растворов веществ. Закончите молекулярные уравнения возможных реакций молекулярные уравнения возможных реакций, составьте для них ионные уравнения составьте для них ионные уравнения а) NaCl и AgNO3 а) Ca(NO3)2 и HCl а) BaCl2 и Na2SO4 а) FeSO4 и КОН б) KNO3 и NaOH б) KOH и HNO3 6) NaOH и FeCl3 б) Na2SO4 и HCl 6.Составьте молекулярное и полное ионное 6.Составьте молекулярное и полное ионное уравнение реакции, соответствующее данному уравнение реакции, соответствующее данному сокращенному: сокращенному: H+ + OH- = H2O Zn2+ +2OH- = Zn(OH)2 3Mg2++2PO43- =Мg3(PO)2 2H++CO32- = H2O+CO2 7. Осуществите превращение 7. Осуществите превращение Ca(OH)2 → CaCO3 CuSO4→ CuS FeCl2 → Fe(OH)2 AgNO3 → Ag2SO4 Реакции ионного обмена Реакции ионного обмена Вариант 1 Вариант 2 Вариант 3 Вариант 4 1.Напишите в ионной форме уравнения реакций, 1.Напишите в ионной форме уравнения реакций, представленных следующими схемами: представленных следующими схемами: Ba(NO3)2 + H2SO4 = Ag2SO4 + K3PO4 = Ag3PO4 H2SO4 + Sr(OH)2 = SrSO4 Ca(NO3)2 + K2CO3 = BaSO4 + HNO3 + K2SO4 + H2O CaCO3 + KNO3 2.Закончите молекулярные уравнения реакций и 2.Закончите молекулярные уравнения реакций и составьте для них ионные уравнения : составьте для них ионные уравнения : AgNO3 + BaCl2 → CaCO3 + НNO3→ BaО + HCl → H2SO4 + Zn(OH)2→ 3. Какие пары ионов могут одновременно . 3. Какие пары ионов могут одновременно находиться в растворе? Объясните, почему. находиться в растворе? Объясните, почему. 2+ -+ -а) Cu и ОН а) Ag и Cl а) Na+ и SO42а) CO32- и Ba2+ 2+ -+ + 2б) Zn и Cl б) H и Br б) H и CO3 б) ОН – и Li+ 4. Напишите ионное уравнение реакции 4. Напишите ионное уравнение реакции между растворами: между растворами: хлорида свинца и сульфата калия и хлорида алюминия и нитрата серебра и иодида сульфида калия бромида бария гидроксида лития магния 5. Определите, в каких случаях может произойти 5. Определите, в каких случаях может произойти взаимодействие растворов веществ. Закончите взаимодействие растворов веществ. Закончите молекулярные уравнения возможных реакций молекулярные уравнения возможных реакций, составьте для них ионные уравнения составьте для них ионные уравнения а) NaCl и AgNO3 а) Ca(NO3)2 и HCl а) BaCl2 и Na2SO4 а) FeSO4 и КОН б) KNO3 и NaOH б) KOH и HNO3 6) NaOH и FeCl3 б) Na2SO4 и HCl 6.Составьте молекулярное и полное ионное 6.Составьте молекулярное и полное ионное уравнение реакции, соответствующее данному уравнение реакции, соответствующее данному сокращенному: сокращенному: H+ + OH- = H2O Zn2+ +2OH- = Zn(OH)2 3Mg2++2PO43- =Мg3(PO)2 2H++CO32- = H2O+CO2 7. Осуществите превращение 7. Осуществите превращение Ca(OH)2 → CaCO3 CuSO4→ CuS FeCl2 → Fe(OH)2 AgNO3 → Ag2SO4





