Учёные НГУ научились видеть активацию тромбоцитов в
реклама

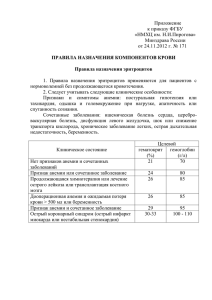
НГУ Учёные НГУ научились видеть активацию тромбоцитов в реальном времени 09.10.2015 Наверное, каждой хозяйке когда-нибудь приходилось порезаться кухонным ножом. Обычно после того как мы поранились, кровь идёт в течение нескольких минут, а затем останавливается. Мало кто задумывается, почему кровотечение прекращается, а между тем это невероятно важное свойство нашего организма – ведь иначе самый маленький порез приводил бы к огромной кровопотере. Так и происходит, например, у больных гемофилией, у которых нарушена система остановки крови. Команда преподавателей и студентов с кафедры биомедицинской физики ФФ НГУ научилась видеть первый шаг в свёртывании крови – активацию тромбоцитов – в реальном времени. Оказывается, в нашем организме предусмотрено два механизма остановки крови. Первый из них – так называемыйсосудистотромбоцитарный гемостаз. Он заключается в сужении сосуда и закупорке отверстия в сосудистой стенке специальными клетками – тромбоцитами – и происходит в течение 1–3 минут после повреждения сосуда. Второй механизм – непосредственно свёртывание крови: из жидкой среды кровь становится вязкой, желеобразной субстанцией. Этот механизм обычно более длительный, ведь он отвечает собственно за заживление раны, в отличие от тромбоцитов, задача которых – изначально уменьшить кровотечение. Активация тромбоцитов – это первая стадия процесса остановки крови. Тромбоцит способен активироваться в ответ на различные химические и физические стимулы (например, холод). Отклонения в этом процессе приводят к различным заболеваниям, кровоизлияниям или, наоборот, закупорке сосудов. Для медицинской диагностики очень важно уметь оценивать способность тромбоцитов к активации. Однако существующие методы имеют фундаментальные ограничения по такой оценке и не позволяют надежно выявлять отклонения в активации тромбоцитов. Преподаватели и студенты кафедры биомедицинской физики ФФ НГУ задались целью решить эту проблему, используя свои знания. Но как разработать универсальный и точный метод, который позволил бы оценить реакцию тромбоцитов на различные стимулы? Как уже говорилось, при повреждении кровеносного сосуда тромбоциты «чувствуют» химические вещества, которые попадают в кровь извне. В результате этого и происходит их активация: форма тромбоцитов меняется со сплюснутой на округлую, появляются длинные выросты – «псевдоподии», – а на клеточной мембране активируются поверхностные рецепторы. С помощью них тромбоциты могут слипаться друг с другом, а также прилипать к повреждённой области сосуда. За счёт этого и образуются агрегаты тромбоцитов, которые механически «затыкают» место кровотечения. Но и это ещё не всё – оказывается, после активации клетки выделяют в кровь гранулы с особыми веществами, которые сами способны активировать тромбоциты! Получается эффект «цепной реакции», благодаря чему процесс остановки крови и происходит так быстро. Различные химические вещества-активаторы запускают каскад разных биохимических реакций внутри тромбоцита. Но всё это приводит к одному эффекту – в цитоплазме клетки появляются свободные ионы кальция, от количества которых зависит степень активации. Слабый стимул приводит к небольшому повышению концентрации ионов и только к изменению формы, а сильный – вызывает резкий всплеск свободного кальция, что ведёт также к перестройке поверхностных рецепторов, агрегации тромбоцитов, выделению активирующих соседние клетки гранул и к появлению на поверхности клеток специальных веществ, ускоряющих свёртывание крови. При этом изменение формы тромбоцитов – это универсальный эффект, который вызывают все активаторы. Получается, научившись с высокой точностью измерять форму тромбоцитов, можно дальше исследовать её изменение при активации и делать выводы о ходе процесса. Высокая точность измерения формы в данном случае является необходимой, так как тромбоциты – маленькие клетки (1–3 микрометра), а их показатель преломления очень близок к воде (клетки очень прозрачные и едва заметны). Это обстоятельство и необходимость регистрировать изменение формы клетки в 3D формате делает обычный световой микроскоп непригодным для решения задачи. Кроме того, нужен метод с высокой статистической достоверностью. Потому было решено использовать метод сканирующей проточной цитометрии, созданный и развиваемый в лаборатории Цитометрии и Биокинетики, которую возглавляет заведующий кафедрой биомедицинской физики профессор Валерий Мальцев, позволяющий измерять индикатрису светорассеяния одиночных клеток за миллисекунду. Индикатриса – это зависимость интенсивности рассеянного излучения от угла рассеяния. Она сильно связана с морфологией клетки и содержит информацию о её форме, размере и внутренней структуре. Таким образом, менее чем за минуту измерения накапливается очень большой объём информации о популяции клеток, исходя из которого, можно получить представление о распределении тромбоцитов по форме. Сам процесс восстановления формы клетки по индикатрисе светорассеяния – это нетривиальная обратная задача, для решения которой необходимо выбрать оптическую модель клетки, а затем произвести глобальную оптимизацию (определить геометрические характеристики клетки). Несмотря на сложность, эта задача была решена, что позволило измерить размеры и форму тромбоцитов с беспрецедентной точностью. Далее проводились исследования крови пациентов. Сначала в пробирку с кровью добавлялся активатор, а затем производилось измерения на цитометре. Оказалось, что форма тромбоцитов при активации действительно меняется, но далеко не у всех клеток! Часть тромбоцитов остаётся дисковидной даже под воздействием большой дозы активатора. И наоборот, даже без добавления активатора существует популяция округлых тромбоцитов. Соотношение двух популяций зависит от вида и дозы активатора. Кроме того, прибор позволяет измерить скорость перехода клеток между популяциями после добавления стимула. Такой метод оценки способности тромбоцитов к активации, несомненно, востребован в медицинской диагностике. Сейчас исследовательская команда совместно с Центром новых медицинских технологий и НИИ патологии кровообращения им. Е.Н. Мешалкина планирует выявить корреляцию новых измеряемых параметров с конкретными болезнями. Кроме медицинских, используемый подход позволяет делать и биологические выводы. Например, современные реагенты позволяют измерить содержание кальция в цитоплазме по сигналу флуоресценции – в присутствии ионов специальный зонд начинает переизлучать свет лазера на другой длине волны. Этот сигнал можно измерить на цитометре одновременно с индикатрисой светорассеяния. Оказалось, что между концентрацией кальция в цитоплазме и формой клетки есть прямая взаимосвязь. Это позволяет подтвердить гипотезу, высказанную в научной литературе в 2014 году: форма тромбоцитов меняется за счёт работы молекулярных моторов – «локомотивов», которые двигаются по кольцу микротрубочек в тромбоците. В неактивированном состоянии это кольцо находится на периферии клетки и растягивает её мембрану, обеспечивая дисковидную форму. При активации кольцо микротрубочек за счёт напряжений, создаваемых молекулярными моторами, выходит из плоскости и превращается в округлую трёхмерную структуру, которая обеспечивает округлую же форму активированного тромбоцита. Форму этой трёхмерной структуры биологи ранее наблюдали, но не могли объяснить. Поскольку биофизики не боятся математики, исследователи сразу же увидели, что её форму можно описать уравнением кривой с избыточной кривизной. Это такая замкнутая трёхмерная кривая, у которой в каждой точке кривизна постоянна и превышает кривизну плоской окружности той же длины. Если теперь понять, что и как именно вызывает избыточную кривизну кольца микротрубочек, это может пролить свет не только на активацию тромбоцитов, но и на другие подобные биологические процессы. Это поможет создать новые медицинские препараты, которые помогут точно контролировать процесс свёртывания крови. Вот так биофизический подход помогает проводить исследования в биологии и медицине. Следующее явление, которое планируется изучить с точки зрения физики – это агрегация тромбоцитов. Скорость и эффективность слипания клеток между собой как раз и определяет время остановки кровотечения. Первые результаты в исследовании агрегации уже получены, но для детального измерения необходимо модифицировать сканирующий проточный цитометр. Новый вариант прототипа анализатора уже находится в процессе сборки. Автор: Александр Москаленский, преподаватель физического факультета НГУ, младший научный сотрудник Института химической кинетики и горения им. В.В. Воеводского Фото: Анастасии Давлетгильдеевой Последняя редакция: 09.10.2015 17:24