Иллюстрации к лекции 1 OH H COOH CH3 C OH H CH3 COOH
реклама
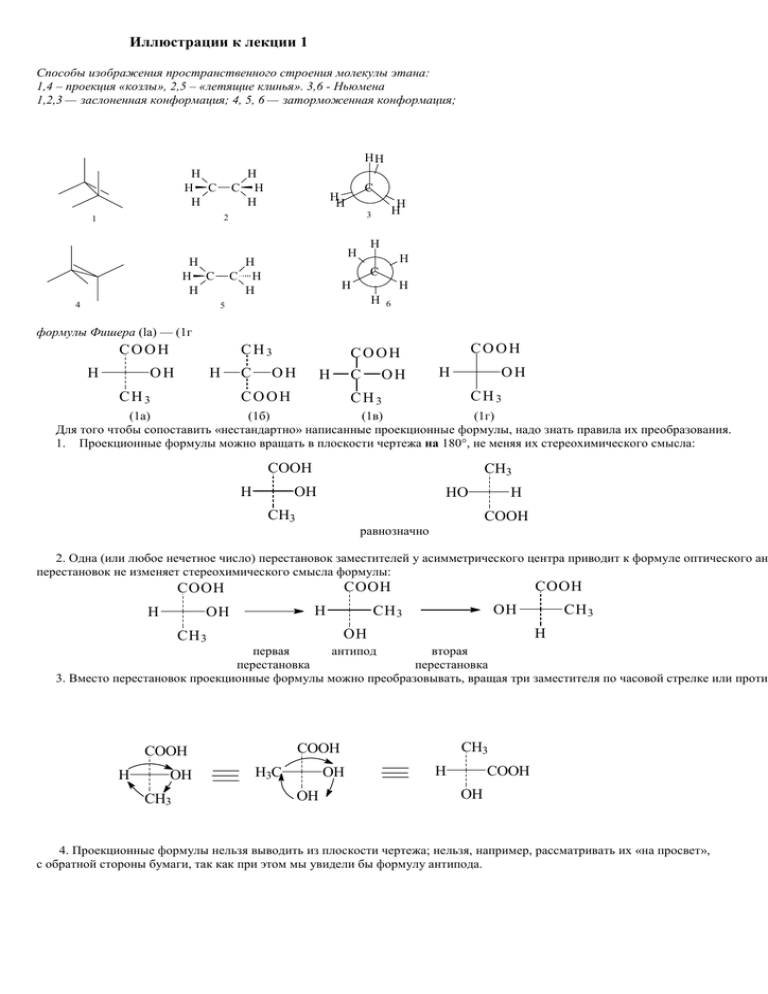
Иллюстрации к лекции 1 Способы изображения пространственного строения молекулы этана: 1,4 – проекция «козлы», 2,5 – «летящие клинья». 3,6 - Ньюмена 1,2,3 — заслоненная конформация; 4, 5, 6 — заторможенная конформация; HH H H C H H C H H C H H H H C H 4 H H 3 2 1 H H H C H H H C H H H 5 6 формулы Фишера (la) — (1г COOH H CH3 OH H CH3 C OH COOH C OH H COOH COOH H OH CH3 CH3 (1а) (1б) (1в) (1г) Для того чтобы сопоставить «нестандартно» написанные проекционные формулы, надо знать правила их преобразования. 1. Проекционные формулы можно вращать в плоскости чертежа на 180°, не меняя их стереохимического смысла: COOH H CH3 OH HO CH3 H COOH равнозначно 2. Одна (или любое нечетное число) перестановок заместителей у асимметрического центра приводит к формуле оптического ан перестановок не изменяет стереохимического смысла формулы: H COOH COOH COOH H OH OH CH 3 H OH CH 3 CH 3 первая антипод вторая перестановка перестановка 3. Вместо перестановок проекционные формулы можно преобразовывать, вращая три заместителя по часовой стрелке или проти H OH CH3 CH3 COOH COOH H3C OH OH H COOH OH 4. Проекционные формулы нельзя выводить из плоскости чертежа; нельзя, например, рассматривать их «на просвет», с обратной стороны бумаги, так как при этом мы увидели бы формулу антипода. CH3 C6H5 CH3 C6H5 CH3 CH CH CH3 C6H5OH H H H CH3 OH H3C H3C H OH (2) CH3 H OH (2а) H C6H5 (2б) (2в) НОМЕНКЛАТУРА ЭНАНТИОМЕРОВ CHO H2N (CHOH)n COOH COOH H H H OH OH CH2OH R R L – аминокислоты D – гидроксокислоты D – моносахариды Система ключей для окси- и аминокислот и моносахаридов Правила IUPAC – R,S-система для энантиомеров 3 3 COOH H1 4 C HO 2 CH3 COOH 1 C H OH H3C 4 R S 2 2R –оксипропановая кислота 2S –оксипропановая кислота 1C HO C6H5 H2N 1S –фенилэтанамин – 1 H 3 4 2 6 CH3 HO 3 2R –оксипропановая кислота 3 4 3 4 R O 6 3R –метилциклогексанон – 1 1 4 R(C2) 1 S(C3) 2 3 H 4 CH3 2 2 2 1 3 1 5 4 H OH 2R, 3S –диоксибутаналь H H3C 1 2 1 5 2 H H H3C H COOH CH3 3 O 4 S O 3S –метилциклогексанон – 1 Соединения с одним асимметрическим атомом Соединения с двумя и более асимметрическими атомами 1 молекула А(+) В(+) 3 молекула А(-) В(+) 2 молекула А(-) В(-) 4 молекула А(+) В(-) Таким образом у молекулы с двумя различными асимметрическими атомами могут быть 4 оптически активных изомера и 2 рацемата. Молекулы 1 и 3, 1 и 4, 2 и 3, 2 и 4 - диастереомерами. HOOC CH CH COOH OH Cl H OH HO H H H Cl Cl H Cl эритро – (–) т.пл. 173˚С [α]D – 31,3˚ OH HO H H Cl H COOH COOH COOH COOH COOH COOH COOH COOH эритро – (+) т.пл. 173˚С [α]D + 31,3˚ трео – (+) т.пл. 167˚С [α]D + 9,4˚ рацемат эритро т.пл. 146˚С трео – (–) т.пл. 167˚С [α]D – 9,4˚ рацемат трео т.пл. 153˚С d420 1,2387 nD20 1,4517 d420 1,2321 nD20 1,4507 Z = 2n , где n – число асимметрических центров. H HO OH H H COOH (+) винная α [α ] = , !⋅d HO COOH COOH COOH COOH H H OH HO H OH H OH HO H COOH (-) винная COOH COOH мезовинная Поляриметрия где α – угол вращения испытуемого вещества в градусах – (°), l – длина трубки в дм, d – плотность вещества в г/см3. α ⋅ 100 Для растворов формула имеет вид [α ] = , !⋅с где с – число граммов опт. акт. вещества в 100мл раствора. Часто вместо удельного вращения пользуются величиной молекулярного вращения [М], которую [α ] , где М – молекулярная масса вещества. вычисляют по формуле [М] = М 100 23 [α ]D , 23 – температура в °С, D – длина волны натрия (источник света в поляриметре натриевая лампа), для которой λ = 589 нм Например, один и тот же антипод яблочной кислоты в водном растворе при различных концентрациях 64% и 21% имеет различное вращение [α ]D23 +2,72° (вода С 64) и [α ]D23 – 0,9° (вода С 21) Пример зависимости удельного вращения зависит от природы растворителя и температуры, один и тот же изомер диэтилового эфира винной кислоты имеет различные значения удельного вращения в разных условиях измерения: чистый(жидкость) [α ]D20 + 7,4° (вода С 21) [α ]D20 + 10,0° (этилацетат) [α ]D20 – 3,19° (хлороформ) [α ]D36 0° (хлороформ) 50 [α ]D + 1,26° (хлороформ)






