CH3CH2C O NH2 CH3CH2CH2C O NH CH3 O C N H R H CH3 C O
реклама
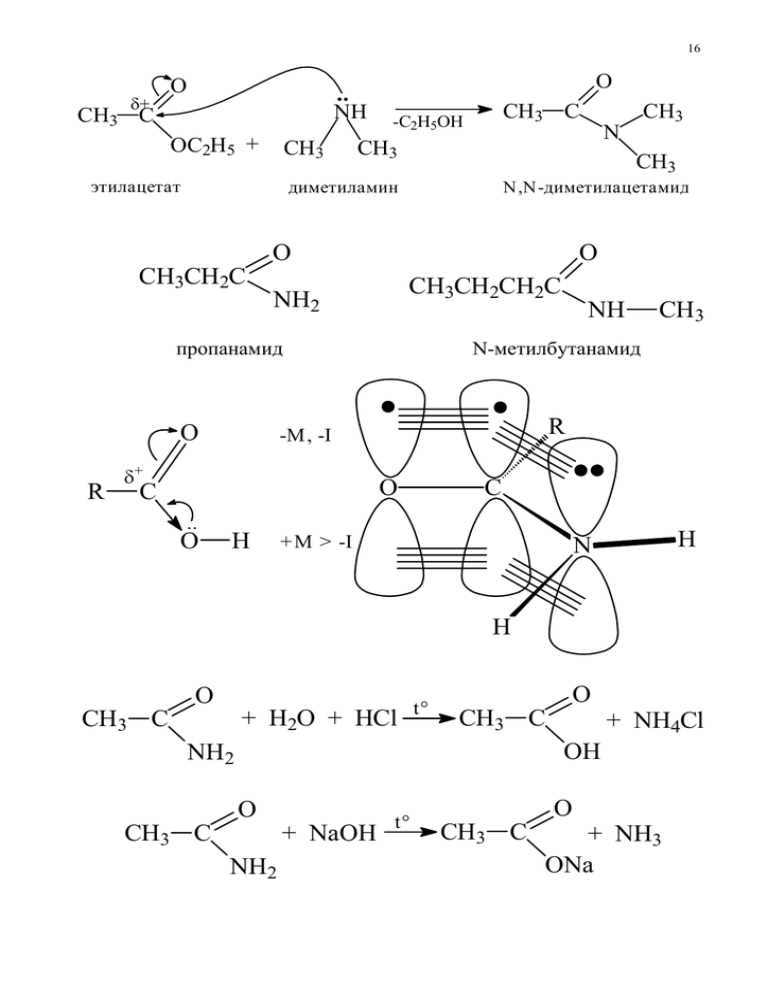
16 δ+ O O NH CH3 C OC2H5 + CH3 этилацетат CH3 N,N-диметилацетамид O O CH3CH2CH2C NH2 пропанамид O .. O H CH3 R O C NH N-метилбутанамид -M, -I δ+ CH3 N CH3 диметиламин CH3CH2C R CH3 C -C2H5OH C + M > -I H N H CH3 C O + H2O + HCl t° CH3 C + NH4Cl OH NH2 CH3 C O O NH2 + NaOH t° CH3 C O + NH3 ONa 17 Ацилирующая способность функциональных производных карбоновых кислот. O R C O R C Cl O R C O R O O R R C OH OR' C NH2 C O хлорангидрид ангидрид карбоновая сложный амид кислота эфир OH- R'O- NH2- карбоксилат- гидроксид- алкоксид- амид-ион ион ион ион O Cl- R C O- хлорид-ион Уменьшение стабильности уходящего иона, снижение ацилирующей способности 18 Реакции с участием радикалов монокарбоновых кислот Галогенирование насыщенных алифатических кислот (реакция Гелля—Фольгарда—Зелинского) CH3 CH3 CH α CH COOH + Br2 H изовалериановая кислота (3-метилбутановая кислота) P CH3 CH3 CH CH COOH + HBr Br α-бромизовалериановая кислота (2-бром-3-метилбутановая кислота) 19 Реакции электрофильного присоединения к ненасыщенным кислотам O CH2 CH C OH + HBr CH2 CH2 Br акриловая кислота (пропеновая кислота) COOH 3-бромпропановая кислота Реакции электрофильного замещения в ароматических кислотах H C O COOH KNO3, H2SO4, 90°C δ- δ- NO2 бензойная кислота 3-нитробензойная кислота 20 Д ИКАРБОНОВЫЕ КИСЛОТЫ Номенклатура, изомерия и физические свойства Таблица – некоторые важнейшие представители дикарбоновых кислот Название Структурная формула pKa1 pKa2 Алифатические Этандиовая (щавелевая) Пропандиовая (малоновая) COOH 1.27 4.27 CH2 COOH 2.86 5.70 HOOC HOOC Бутандиовая (янтарная) HOOC (CH2)2 COOH 4.21 5.64 Пентандиовая (глутаровая) HOOC (CH2)3 COOH 4.34 5.27 Гександиовая (адипиновая) HOOC (CH2)4 COOH 4.41 5.28 Непредельные цис-Бутендиовая (малеиновая) HOOC HC COOH CH 1.92 6.23 HOOC транс-Бутендиовая (фумаровая) HC CH 3.02 4.38 COOH Ароматические COOH Бензол-1,2-дикарбоновая 2.58 5.64 (фталевая) COOH 21 COOH COOH COOH COOH COOH COOH Бензол- Бензол- Бензол- 1,2-дикарбоновая 1,3-дикарбоновая 1,2-дикарбоновая (фталевая кислота) (изофталевая кислота) (терефталевая кислота) Химические свойства Кислотные свойства O O HOOC C OH щавелевая кислота HOOC COOH + NaOH -H + HOOC C O- гидроксалат-ион HOOC COONa + H2O гидроксалат натрия (кислая соль) HOOC COOH + 2NaOH NaOOC COONa + 2H2O оксалат натрия (средняя соль) 22 Реакции нуклеофильного замещения O C2H5OH O C -H2O C OC2H5 HO этилгидроксалат HOOC COOH O 2C2H5OH O C C -2H2O C2H5O OC2H5 диэтилгидроксалат Специфические реакции дикарбоновых кислот O O C HO 200°С C H C OH + CO2 OH щавелевая кислота муравьиная кислота O O O C HO O 150°С CH2 C OH малоновая кислота CH3 C + CO2 OH уксусная кислота 23 O O CH2 C CH2 C OH OH CH2 C 220-230°C -H2O O CH2 C O O янтарная кислота янтарный ангидрид O O CH2 C H2C CH2 OH OH CH2 C t° -H2O O H2C CH2 C C O O глутаровая кислота глутаровый ангидрид Ги дро кси ки сл оты • Гидроксикислоты содержат в молекуле одновременно карбоксильную и гидроксильную группы. А ли фати ч е ск ие гидро кси ки слоты Номенклатура и изомерия β α CH3 CH OH COOH 2-гидроксипропановая (молочная) кислота 24 β α CH3 CH COOH 3-гидроксипропановая кислота OH γ β α CH2 CH2 CH2 COOH 4-гидроксибутановая кислота OH Способы получения Получение из галогенозамещенных карбоновых кислот CH3 CH2 CH COOH + 2NaOH CH3 CH2 CH Br COONa + H2O OH 2-бромбутановая кислота 2-гидроксибутановая кислота Получение из а-гидроксинитрилов O CH3 CH C N + 2H2O OH CH3 CH C OH OH + NH4Cl Химические свойства Реакции карбоксильной группы Взаимодействие со щелочами CH3 CH CH2 COOH + NaOH OH 3-гидроксибутановая кислота CH3 CH CH2 OH 3-гидроксибутаноат натрия COONa + H2O 25 Взаимодействие со спиртами O CH3 CH C + CH3OH H2SO4 O CH3 CH OH OH OH C + H2O OCH3 Взаимодействие с галогенидами фосфора O CH2 CH2 C CH2 CH2 C + 2PCl5 OH OH O + 2POCl3 + 2HCl Cl Cl хлорангидрид 3-хлорпропановой кислоты 3-гидроксипропановая кислота Реакции гидроксильной группы Ацилирование O CH2 COOH + CH3 C OH гидроксиуксусная кислота Cl ацетилхлорид CH3 C O CH2COOH + HCl O О-ацетилгликолевая кислота Взаимодействие с галогенводородами CH3CHCOOH + HBr OH 2-гидроксипропановая кислота CH3CHCOOH + H2O Br 2-бромпропановая кислота 26 Окисление H HO O C C H O [O] OH O C C H OH Специфические свойства α-Гидроксикислоты O C O H OH CH3 CH O + O CH CH3 HO H C O CH3 CH C сложноэфирные группы CH CH3 O O C O молочная кислота лактид β-Гидроксикислоты O CH3 CH CH OH C β H H CH3CH -H2O α CHCOOH 2-бутеновая кислота 3-гидроксибутановая кислота γ- и δ-Гидроксикислоты CH2 δ+ O O C H2C CH2 O OH H γ-гидроксимасляная кислота CH2 -H2O H2C CH2 C O γ-бутиролактон Сложноэфирная группа 27 H H O HH C C H H H C H H δ+ COOH C H H H C зигзагообразная конформация C H O δ+ OH C O H клешевидная конформация Разложение α-гидроксикислот H R C O C H2SO4 R C OH OH α-гидроксикислота O O H альдегид + H C OH муравьиная кислота Фенолокислоты COOH COOH COOH OH OH OH 2-гидроксибензойная 3-гидроксибензойная 4-гидроксибензойная (салициловая) кислота кислота кислота 28 COONa COOH ONa OH HCl CO2 феноксид натрия салицилат натрия OH салициловая кислота Получение феноксида натрия O H 'δ- 'δ- O-Na+ δ- NaOH δ- δ- > δ- δ- 'δ- Карбоксилирование O O-Na+ O + OH H O C C O σ-комплекс O-Na+ O C ONa 29 Химические свойства Кислотные свойства O C O OH COOH водородная связь COONa OH OH + NaHCO3 + CO2 + H2O COOH COONa OH ONa + NaOH + 2H2O Реакции карбоксильной группы COOH COOCH3 OH + CH3OH H2SO4 ONa + H2O 30 COOH COOC6H5 COCl OH OH POCl3 OH C6H5OH -HCl фенилсалицилат (салон) хлорангидрид салициловой кислоты Реакции фенольной гидроксильной группы COOH O COOH O CH3 C OH O + C CH3 O CH3 C + CH3COOH O ацетилсалициловая кислота уксусный ангидрид COOH COOH O C OH CH3 O + CH3COOH + H2O Декарбоксилирование COOH OH OH + CO2 31 HO HO HO HO COOH + CO2 HO HO галловая (3,4,5-тригидроксибензойная) кислота пирогаллол (1,2,3-тригидроксибензол) Оксокарбоновые ки слоты • Оксокарбоновые кислоты, т. е. альдегидо- и кетонокислоты, — это соединения, содержащие наряду с карбоксильной и карбонильную группу (альдегидную или кетонную). β α CH3 C γ COOH β α CH3 C O CH2 COOH O 2-оксопропановая 3-оксобутановая (пировиноградная) кислота (ацетоуксусная) кислота CH3 CH OH COOH молочная кислота [O] CH3 C O COOH пировиноградная кислота 32 NaOH CH3 C O C O CH3 C ONa O + H2O пируват натрия OH O C C2H5OH, H+ O CH3 C C OC2H5 O + H2O этилпируват H2N-OH -H2O CH3 C CH3 C N O C O C OH оксим пировиноградной кислоты OH O OH H2N-NH2 -H2O O CH3 C C OH NH2 N гидразон пировиноградной кислоты CH3 C O CH3 C O C O H2SO4 CH3 C OH CH2 COOH O + CO2 H ацетальдегид CH3 C O ацетон CH3 + CO2 33 • Таутомерия (динамическая изомерия) — это подвижное равновесие между взаимопревращающимися структурными изомерами. кетонная CH3 C енольная CH2 COOC2H5 CH3 C O CH COOC2H5 OH Таутомерные формы ацетоуксусного эфира CH-кислотный центр H α CH3 C C O H O C OC2H5 основной центр Кетонная форма ацетоуксусного эфира H CH3 C O сопряженная система C H C O OC2H5 внутримолекулярная водородная связь Енольная форма ацетоуксусного эфира








