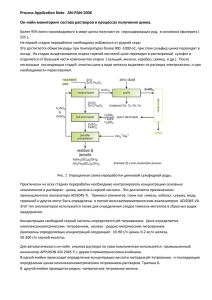
Установка для получения водорода
реклама

Установка для получения водорода Область: Химия Ваша фирма поставляет демонстрационные комплекты для химиков. Это аппарат Киппа ­ один из самых известных приборов для получения газов. Он широко используется для лекционных демонстраций и учебных лабораторных работ (в исследовательских и контрольных лабораториях химики предпочитают использовать в качестве источника газов баллоны, это безопаснее и удобнее). Оборудование уже заказано, остаётся рассчитать количество реактивов. Определите, сколько цинка (чистотой W(Zn)*100%), серной кислоты (плотностью P(H 2SO 4), г/мл) и воды необходимо для получения V(H 2 идеал) литров водорода при с.у. при условии, что в аппарат Киппа необходимо заливать серную кислоту концентрации 20%, а реакция проходит до конца. Молярную массу цинка примите равной 65,4 г/моль. Справочные данные Аппарат Киппа Принцип действия аппарата Киппа прост. Рассмотрим его на примере получения водорода. На дне среднего резервуара есть решетка, на которой расположены гранулы цинка. В аппарат наливают кислоту (серную или соляную). Когда кран на газоотводной трубке закрыт, кислота находится в верхней воронке и нижнем резервуаре. Как только открывают кран, кислота течет из воронки и заполняет нижнюю часть второго резервуара, в результате начинается реакция с цинком, выделяется водород. Когда эксперимент окончен, кран закрывают, и водород перестает выходить из аппарата Киппа. Давление газа вытесняет кислоту в воронку до тех пор, пока контакт кислоты и цинка не прекратится. Выделение водорода останавливается. Если открыть кран (на газоотводной трубке), кислота снова попадет из воронки во второй резервуар и поток водорода возобновится. Реакция между цинком и серной кислотой Взаимодействие между цинком и серной кислотой может протекать по нескольким путям. Два основных – приведены в уравнениях реакции (1) и (2). Также, в случае реакции с концентрированной серной кислотой, в продуктах взаимодействия можно обнаружить примеси серы и диоксида серы. (1) Zn + H SO → ZnSO + H ↑ 2 4(разб) 4 2 (2) 4Zn + 5H SO → 4ZnSO + H S↑ + 4H O 2 4(конц) 4 2 2 Таким образом, в рассматриваемой системе идут два конкурирующих процесса. При низких концентрациях серной кислоты можно пренебречь наличием примесей в получаемом водороде, но при концентрации кислоты более 20% доля примесей превышает допустимый порог. С другой стороны, скорость этой реакции зависит от температуры, степени измельчения цинка и концентрации серной кислоты. Подогревать систему не рекомендуется (смесь водорода с кислородом взрывоопасна), цинк поставляется стандартными брусками и его измельчение связано с серьезными трудозатратами. Таким образом, концентрация серной кислоты является самым удобным способом воздействия на скорость реакции. Чтобы добиться максимальной скорости реакции используйте максимально возможную концентрацию серной кислоты. Уравнение состояния идеального газа Если известно давление, температура и количество моль газа, то объем, занимаемый этим газом, можно определить по уравнению состоянию идеального газа (также известному как уравнение Клапейрона­Менделеева). pV = nRT Если принять количество газа за 1 моль, то при нормальных условиях (0⁰С, 101300 Па, часто 3 используется сокращение н.у.) его объем будет равен 0,0224 м или 22,4 литра. Этот же результат может быть получен в качестве следствия из закона Авогадро. Однако, в лабораторной практике расчет обычно проводиться при стандартных условиях (25⁰С, 101300 Па, часто используется сокращение с.у.). Чистота исходных веществ Часто приходится иметь дело с реактивами, которые содержат те или иные примеси. Содержание основного вещества обычно указывается в %. Например, 100 г 96% раствора серной кислоты содержат 96 г серной кислоты и 4 г воды. В случае с растворами не всегда известна концентрация поставляемых реактивов. В этом случае, один из самых простых способов определить массовую долю вещества в растворе – измерить плотность раствора и затем по справочным таблицам узнать массовую долю. Таблица 1: плотность растворов серной кислоты различной концентрации Плотность, г/мл Массовая доля H SO , 2 4 % 1,270 36,19 1,400 50,50 1,500 60,17 1,620 70,82 Плотность, г/мл Массовая доля H SO , % 2 4 1,730 1,800 1,825 1,835 Экономика Стоимость создания опытного образца: P = 1 МР E Стоимость создания производственной линии: P = 50 МР I Стоимость контроля качества: P = 5 МР Q 80,25 87,69 92,51 95,72