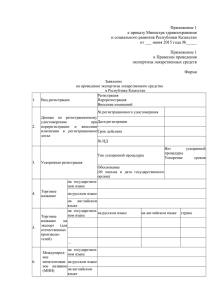
ПРИЛОЖЕНИЕ 2 ЗАЯВКА на регистрацию лекарственного
реклама

ПРИЛОЖЕНИЕ 2 ЗАЯВКА на регистрацию лекарственного средства вРеспубликеУзбекистан APPLICATION for registration of the preparation in the Republic of Uzbekistan 1. Фирма-заявитель, страна Firm-applicant., country 2. Фирма-производитель, страна Manufacturing firm, country 3. Фирма-владелец патента Firm-Holder of the patent 4. Фирма-производитель активной субстанции, страна Manufacturing firm of active substance, country 5. Название лекарственного средства Name of the preparation 6. Международное непатентованное название International nonproprletary name (INN) 7. Основные синонимы Main synonims of the preparation 8. Состав лекарственного средства Composition of the preparation 9. Лекарственная форма Meditional form 10 .Дозы лекарственного средства Dosage of the preparation 11 .Способ применения лекарственного средства (внутрь, инъекции и т.д.) Administration (oral, injectable, ets) 12.Основные показания для применения лекарственного средства Main indications for administration 13. Сроки хранения и требования, предъявляемые к хранению лекарственного средства Storage term and reguirements 14. Стандартная упаковка Standard package 15. К какой группе относится препарат: 1. Venena- список А (ядовитые) 2. Heroica - список Б (сильнодействующие) 3. Общий список 4. Психотропные средства 5. Наркотические средства 16.Способ отпуска препарата (по рецепту или без рецепта) Подпись Печать ПРИЛОЖЕНИЕ 4 СПИСОК документов, необходимых для рассмотрения вопроса о регистрации новых лекарственных средств в Республике Узбекистан 1. Заявка на регистрацию на русском языке (см. прилож. 2) 2. Сводная (обобщенная) справка о препарате, содержащая краткую суммирующую информацию по каждому из приведенных ниже пунктов. 3. Инструкция по медицинскому применению (или клиническому изучению) на русском языке. 4. Сертификат о регистрации лекарственного средства в стране-производителе и в других странах (оригинал или заверенная копия) 5. Сертификат, удостоверяющий производство препарата в условиях GMP (оригинал или заверенная копия) 6. Нормативная документация, используемая при контроле качества препарата на языке оригинала и на русском языке (см. прил.4а). 7. Сертификат качества конечного продукта и субстанции действующих веществ. 8. Отчет об изучении фармакологической (специфической) активности, обосновывающий все показания для применения, указанные в инструкции. 9. Отчет об изучении токсичности (острая, подострая, субхроническая и хроническая токсичность). 10. Отчет об изучении специфических видов действия (канцерогенное, мутагенное, тератогенное действие, эмбриотоксичность, аллергизирующее и местнораздражающее свойства и т.д.). 11 . Отчеты о клинических испытаниях на русском языке. 12. Имеющиеся данные о фармакокинетических исследованиях препарата в эксперименте и клинике. 13. Данные о применении препарата в клинике после его регистрации (копии публикаций). Необходимо представить только копии публикаций препарата, производимого данной фирмой. 14. Обобщенные данные о побочных эффектах препарата, в том числе в сравнении с другими препаратами, применяющимися по тем же показаниям. 15. Программа клинического апробирования на русском языке. 16. Образцы препарата для трехкратного анализа и субстанции действующего вещества. 17. Описание и образец упаковки. Досье представляется в двух экземплярах.