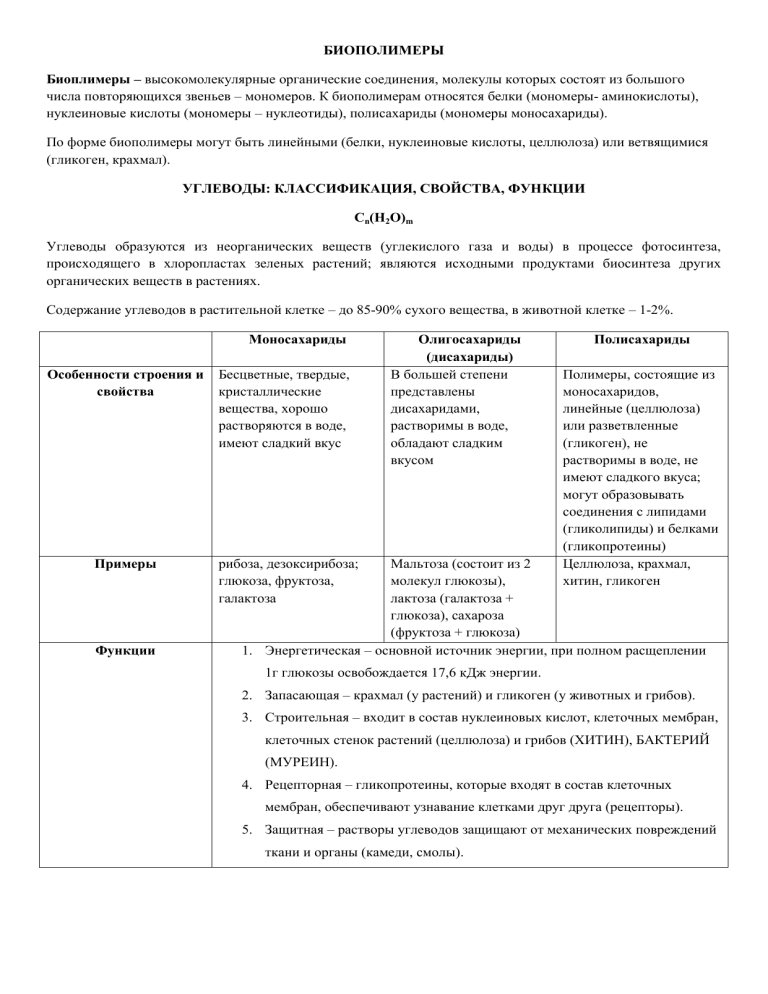
БИОПОЛИМЕРЫ Биоплимеры – высокомолекулярные органические соединения, молекулы которых состоят из большого числа повторяющихся звеньев – мономеров. К биополимерам относятся белки (мономеры- аминокислоты), нуклеиновые кислоты (мономеры – нуклеотиды), полисахариды (мономеры моносахариды). По форме биополимеры могут быть линейными (белки, нуклеиновые кислоты, целлюлоза) или ветвящимися (гликоген, крахмал). УГЛЕВОДЫ: КЛАССИФИКАЦИЯ, СВОЙСТВА, ФУНКЦИИ Сn(H2O)m Углеводы образуются из неорганических веществ (углекислого газа и воды) в процессе фотосинтеза, происходящего в хлоропластах зеленых растений; являются исходными продуктами биосинтеза других органических веществ в растениях. Содержание углеводов в растительной клетке – до 85-90% сухого вещества, в животной клетке – 1-2%. Моносахариды Особенности строения и свойства Примеры Функции Бесцветные, твердые, кристаллические вещества, хорошо растворяются в воде, имеют сладкий вкус Олигосахариды (дисахариды) В большей степени представлены дисахаридами, растворимы в воде, обладают сладким вкусом рибоза, дезоксирибоза; глюкоза, фруктоза, галактоза Полисахариды Полимеры, состоящие из моносахаридов, линейные (целлюлоза) или разветвленные (гликоген), не растворимы в воде, не имеют сладкого вкуса; могут образовывать соединения с липидами (гликолипиды) и белками (гликопротеины) Целлюлоза, крахмал, хитин, гликоген Мальтоза (состоит из 2 молекул глюкозы), лактоза (галактоза + глюкоза), сахароза (фруктоза + глюкоза) 1. Энергетическая – основной источник энергии, при полном расщеплении 1г глюкозы освобождается 17,6 кДж энергии. 2. Запасающая – крахмал (у растений) и гликоген (у животных и грибов). 3. Строительная – входит в состав нуклеиновых кислот, клеточных мембран, клеточных стенок растений (целлюлоза) и грибов (ХИТИН), БАКТЕРИЙ (МУРЕИН). 4. Рецепторная – гликопротеины, которые входят в состав клеточных мембран, обеспечивают узнавание клетками друг друга (рецепторы). 5. Защитная – растворы углеводов защищают от механических повреждений ткани и органы (камеди, смолы). Липиды. 1. ТРИГЛИЦЕРИДЫ (животные жиры, растительные масла) Состав: глицерин и жирные кислоты. Жирные кислоты могут быть насыщенными и ненасыщенными. Ненасыщенные содержат двойные связи. Чем больше двойных связей в остатках жирных кислот, тем более жидким является жир (низкая температура плавления). Жидкие жиры называют маслами, и они обычно растительного происхождения. Функции: 1. Энергетическая – при полном расщеплении 1г жира высвобождается 38,9 кДж энергии. 2. Запасающая – откладываются в клетках жировой ткани, источник энергии во время спячки, миграций, голода. 3. Источник метаболической воды – при окислении 1г жира образуется 1,1г воды 4. Защитная – амортизация органов, теплоизоляция. 2. Фосфолипиды. Состав: глицерин, жирные кислоты, остатки фосфорной кислоты. Остаток фосфорной кислоты совместно с глицерином образуют гидрофильную группу (гидрофильная взаимодействует с водой), а жирная кислота по-прежнему остается гидрофобной. Фосфолипиды образуют каркас клеточной мембраны, т.е. выполняют структурную функцию. 3. Стеролы (стериды) Состав: включают холестерин и его производные. Сам холестерин входит в состав мембран клеток. Это особенно важно для мембран животных клеток, т.к. они не имеют клеточных стенок, и мембране требуется придать жесткость. Это и делают молекулы холестерина. Производные холестерина образуют гормоны надпочечников и минералкортикоиды (альдостерон), глюкокортикоиды (кортизол) и половые гормоны. 4. Воски Пчелиный и растительный. Пчелы используют воск для строительства сот. Некоторые растения имеют восковую кутикулу для уменьшения процесса испарения (например, хвойные). 5. Гликолипиды. Гликолипиды состоят из жиров и углеводов. Широко распространены в нервной ткани, в мозге. 6. Липопротеиды. Липопротеиды состоят из жиров и белков. В таком виде транспортные белки крови переносят липиды. БЕЛКИ Белки (полипептиды) – биологические полимеры, мономерами которых являются аминокислоты. В образовании природных белков принимают участие 20 АК, из них для человека 10 являются незаменимыми, т.к. не могут синтезироваться в организме и должны поступать с пищей. Аминокислоты – низкомолекулярные органические соединения, содержащие карбоксильную группу – СООН (обладает кислотными свойствами) и аминогруппу – NH2 (обладает основными свойствами), имеют общий план строения и между собой различаются только радикалами. Аминокислоты – амфотерные соединения (проявляют свойства кислот и оснований). Соединяясь между собой, АК образуют прочные ковалентные полярные связи – пептидные. Пептидная связь – ковалентная связь, образованная карбоксильной группой одной аминокислоты и аминогруппой другой АК. СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ Структура Характеристика Тип связи белка Первичная Линейная структура – последовательность аминокислот в Пептидная полипептидной цепи, которая определяет все другие структуры молекулы, а также свойства и функции белка. первичная структура определяется последовательностью нуклеотидов в участке молекулы ДНК, кодирующем данный белок. Первичная структура любого белка уникальна и определяет его форму, свойств аи функции. Закручивание полипептидной цепи в спираль или складывание в Водородные связи между Такую «гармошку». атомами водорода групп структуру -спираль Вторичная формируется в результате скручивания NH - и атомами имеют полипептидной цепи в спираль с одинаковыми расстояниями кислорода групп СО- актин, между витками. Она характерна для глобулярных белков, миозин, имеющих сферическую форму глобулы. фибриноген. - структура представляет собой продольную укладку трех полипептидных цепей. Она характерна для фибриллярных белков, имеющих вытянутую форму фибриллы. Третичная ГЛОБУЛЯРНЫЙ БЕЛОК – упаковка вторичной структуры ( Ионные, водородные, дисульфидные, ) в глобулу; имеет вид компактных телец, гидрофобные растворимы в воде. ФИБРИЛЛЯРНЫЙ – несколько вторичных структур (βспираль), уложенных параллельными слоями, или скручивание нескольких вторичных структур наподобие каната в суперспираль; представляют собой длинные тяжи, нити, волокна; нерастворимы в воде, обладают большой механической прочностью, выполняет в клетке и организме структурную и сократительную функции. Четвертичная Встречается редко. Комплекс из нескольких третичных структур органической природы и неорганическое вещество, например Иионные, водородные, гидрофобные гемоглобин. ГЛОБУЛЯРНЫЙ БЕЛОК – упаковка вторичной структуры ( ) в глобулу; имеет вид компактных телец, растворимы в воде. ФИБРИЛЛЯРНЫЙ – несколько вторичных структур (β- спираль), уложенных параллельными слоями, или скручивание нескольких вторичных структур наподобие каната в суперспираль; представляют собой длинные тяжи, нити, волокна; нерастворимы в воде, обладают большой механической СВОЙСТВА БЕЛКОВ Физические и химические свойства белков обусловлены разным аминокислотным составом. Под влиянием различных факторов: высокой температуры, действия химических веществ, облучения, механического воздействия – может произойти разрушение структуры белковой молекулы. Денатурация – нарушение природной структуры белка. Ренатурация – восстановление природной структуры молекулы белка (обратимая денатурация). Необратимая денатурация – происходит разрушение не только третичной и вторичной структур, но и первичной. ФУНКЦИИ БЕЛКА Функции Строительная (структурная) Двигательная Транспортная Защитная Сигнальная (рецепторная) Регуляторная Характеристика Входят в состав клеточных мембран и органоидов клетки (липопротеиды, гликопротеиды), участвуют в образовании стенок кровеносных сосудов, хрящей, сухожилий (коллаген), волос (кератин), связки и стенки кровеносных сосудов (эластин) Обеспечивается сократительными белками (актин и миозин), которые обуславливают движение ресничек и жгутиков, сокращение мышц, тубулин образует микротрубочки и обеспечивает работу веретена деления, перемещение хромосом при делении клетки; движение органов растений. Связывают и переносят с током крови многие химические соединения, например, гемоглобин и миоглобин транспортируют кислород, белки сыворотки крови переносят гормоны, липиды и жирные кислоты, различные биологически активные вещества Выработка антител (иммуноглобулинов) в ответ на проникновение в нее чужеродных веществ (антигенов), которые обеспечивают иммунную защиту; участие в процессах свертывания крови (фибриноген, протромбин); интерфероны – универсальные противовирусные белки Прием сигналов из внешней среды и передача команд в клетку за счет изменения третичной структуры встроенных в мембрану белков в ответ на действие факторов внешней среды. Например, гликопротеины (встроены в гликокаликс), опсин (составная часть светочувствительных пигментов родопсина и йодопсина, находящихся в клетках сетчатки глаза), фитохром (светочувствительный белок растений) Белки-гормоны оказывают влияние на обмен веществ, т.е. обеспечивают гомеостаз, регулируют рост, размножение, развитие и другие жизненно важные процессы. Каталитическая (ферментативная) Запасающая Пищевая (основной источник аминокислот) Энергетическая Например, инсулин и глюкагон регулирует уровень глюкозы в крови, тироксин – физическое и психическое развитие, соматотропин – регулирует рост, Белки-ферменты ускоряют биохимические процессы в клетке. Белки-ферменты катализируют протекание в организме химических реакций. Например, каталаза – разлагает перекись водорода, амилаза гидролизует крахмал, липаза – жиры, трипсин – белки, нуклеаза нуклеиновые кислоты, ДНК-полимераза катализирует удвоение ДНК Резервные белки животных: альбумин (яйца) запасает воду, ферритин – железо в клетках печени, селезенки; миоглобин – кислород в мышечных волокнах, казеин – молоко, белки семян – источник питания для зародыша Белки пищи – основной источник аминокислот (особенно незаменимых для животных и человека; казеин (белок молока) – основной источник аминокислот для детенышей млекопитающих Являются источником энергии – при окислении 1г белка выделяется 17,6 кДж энергии, но организм очень редко использует белки в качестве источника энергии, например, при длительном голодании ПРОСТЫЕ И СЛОЖНЫЕ БЕЛКИ ПРОТЕИНЫ (простые белки) – входят только аминокислоты, к ним относятся многие ферменты (альбумины (яичный, сывороточный), глобулины (антитела, фибриноген крови), основные белки гистоны, содержащиеся в ядрах клеток, фибриллярные белки (кератин, коллаген волос и сухожилий). ПРОТЕИДЫ (сложные белки) – белки, содержащие, помимо аминокислот небелковые компоненты. Такие белки подразделяются на группы, в зависимости от состава небелковой части: ГЛИКОПРОТЕИДЫ – состоят из белка и различных углеводов (муцин слюны, муреин оболочек клеток бактерий) ЛИПОПРОТЕИДЫ – белок и липидные молекулы (компоненты клеточных мембран) ФОСФОПРОТЕИДЫ – имеют в своем составе фосфорную кислоту (казеин молока) НУКЛЕОПРОТЕИДЫ – связаны с нуклеиновыми кислотами, они образуют хромосомы клетко и являются компонентами наследственного аппарата вирусов. ФЕРМЕНТЫ Ферменты (энзимы) – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов. Ферменты отличаются от химических катализаторов высокой степенью специфичности, т.е. фермент катализирует только одну реакцию или действует только на один тип связи. ОТЛИЧИЯ ФЕРМЕНТОВ ОТ КАТАЛИЗАТОРОВ НЕОРГАНИЧЕСКОЙ ПРИРОДЫ: 1. Один фермент катализирует только один тип реакций. 2. Активность ферментов ограничена довольно узкими температурными рамками (обычно 36-380С) 3. Ферменты активны при определенных значениях рН (большинство в слабощелочной среде). СВОЙСТВА ФЕРМЕНТОВ: 1. 2. 3. 4. Каждый фермент ускоряет только один тип реакций. Сам фермент в ходе реакции не изменяется. Активность фермента проявляется только в определенных условиях среды. Структура активного центра фермента строго соответствует структуре субстрата – вещества, на которое он действует. СТРУКТУРА ФЕРМЕНТОВ: 1. БЕЛКОВЫЙ КОМПОНЕНТ (АПОФЕРМЕНТ) 2. Сложное небелковое органическое соединение (КОФЕРМЕНТ), или ионы металлов (КОФАКТОР). АКТИВНОСТЬ ФЕРМЕНТОВ ЗАВИСИТ ОТ: ТЕМПЕРАТУРЫ (наиболее активны при темп. 36-38 град.) РЕАКЦИИ СРЕДЫ КОНЦЕНТРАЦИИ ВЕЩЕСТВ ДЕЙСТВИЕ ВЫСОКИХ ТЕМПЕРАТУР, СИЛЬНЫХ ЩЕЛОЧЕЙ, КИСЛОТ И ЯДОВ, РАДИАЦИИ приводит к НЕОБРАТИМОЙ ДЕНАТУРАЦИИ ФЕРМЕНТОВ, разрушению пептидных связей, что нарушает обменные процессы и приводит к гибели клеток. НУКЛЕИНОВЫЕ КИСЛОТЫ НУКЛЕИНОВЫЕ КИСЛОТЫ – биополимеры, построенные из мономеров – нуклеотидов и обеспечивающие хранение и передачу наследственной информации в живых организмах. Открыты Ф. Мишером (1869г, Швейцария) В молекулах нуклеиновых кислот содержится от 80 до нескольких сот миллионов нуклеотидов Нуклеиновые кислоты содержатся в ядрах, митохондриях, пластидах клеток. НУКЛЕОТИД – органическое соединение, в состав которого входят: одно из пяти азотистых оснований (аденин, гуанин, цитозин, тимин, урацил), пятицглеродный сахар (рибоза или дезоксирибоза) и остаток фосфорной кислоты. НАЗВАНИЕ И ОБОЗНАЧЕНИЕ НУЛЕОТИДОВ: А – адениловый Г – гуаниловый Ц – цитидиловый Т – тимидиловый У – урациловый Комплементарные нулеотиды – это пары нуклеотидов А = Т, а также Г ≡ Ц, между азотистыми основаниями которых образуются водородные связи. ДНК 1. Состав ДНК УГЛЕВОД – дезоксирибоза (пятиуглеродный сахар) АЗОТИСТОЕ ОСНОВАНИЕ – аденин, тимин, гуанин, цитозин ОСТАТОК ФОСФОРНОЙ КИСЛОТЫ 2. Структура ДНК Впервые расшифрована Д. Уотсоном и Ф. Криком 1953г; ДНК состоит из двух цепочек, спирально закрученных одна относительно другой; Связь между нуклеотидами в цепи ДНК – ковалентные связи между гидроксильной группой дезоксирибозы одного нуклеотида и остатком фосфорной кислоты другого нуклеотида; Связи между цепями ДНК водородные, образованы по принципу комплементрности А = Т, Г ≡ Ц КОМПЛЕМЕНТАРНОСТЬ – принцип, в соответствии с которым объединяются 2 полинулеотидные цепи ДНК, осуществляется синтез всех цепей РНК, синтез белка на Ирнк в рибосомах (А = Т, Г ≡ Ц) ПРАВИЛО ЧАРГАФА (следствие комплементарности нуклеотидов): число адениловых оснований равно числу тимидиловых (А = Т), а число гуаниловых равно числу цитидиловых (Г = Ц); отсюда следует А+Г=Т+Ц 3. Свойства ДНК: КОМПЛЕМЕНТАРНОСТЬ ДВУХ ЦЕПЕЙ АНТИПАРАЛЛЕЛЬНОСТЬ ДВУХ ЦЕПЕЙ СПОСОБНОСТЬ К ТРАНСКРИПЦИИ – синтез молекулы РНК, комплементарно на участке матричной ДНК РЕПЛИКАЦИЯ (или удвоение) ДНК – реакция матричного синтеза новой молекулы ДНК как точной копии уже существующей молекулы ДНК (матрицы); происходит под действием ферментов; происходит при подготовке клетки к делению; реакция матричного синтеза идет по принципу комплементарности. ЭТАПЫ РЕПЛИКАЦИИ ДНК: Раскручивание молекулы ДНК Разделение ферментом двух цепей Комплементарное присоединение ферментом ДНК-полимеразой свободных нуклеотидов к двум цепям Образование двух молекул ДНК РЕПЛИКАЦИЯ ДНК ЯВЛЯЕТСЯ: МАТРИЧНЫМ СИНТЕЗОМ – синтез идет на ДНК матрице. СИММЕТРИЧНЫМ – одновременно на обоих цепях. ПОЛУКОНСЕРВАТИВНЫМ – молекула ДНК состоит из одной материнской и одной новой цепи. ИДЕТ ПО ПРИНЦИПУ КОМПЛЕМЕНТАРНОСТИ РЕПЛИКАЦИЯ ИДЕТ В НАПРАВЛЕНИИ 5/ → 3/ ЗНАЧЕНИЕ РЕПЛИКАЦИИ: благодаря ей происходят процессы деления клеток и размножения организмов. РЕПАРАЦИЯ – процесс исправления повреждений (восстановления) в молекулах ДНК и компенсации уже закрепившихся мутаций. ТРАНСКРИПЦИЯ: это процесс «считывания» генетической информации с одной из цепей ДНК и копирования ее на молекулу Ирнк; является первым этапом реализации генетической информации в живых клетках; транскрипция происходит с помощью фермента РНК-полимеразы, осуществляется по принципу комплементарности. 4. Локализация ДНК в клетке: Ядро (в составе хромосом – около 99%) Митохондрии и пластиды эукариотической клетки В прокариотических клетках погружена в цитоплазму. РАССТОЯНИЕ МЕЖДУ НУКЛЕОТИДАМИ 0,34 нм ПОЛНЫЙ ОБОРОТ СПИРАЛИ (один виток) – 10 нуклеотидов 5. ФУНКЦИИ ДНК Хранение и передача наследственной информации в клетке; В молекулах ДНК зашифрована информация о первичной структуре белка; ДНК является матрицей для синтеза всех видов РНК и новых молекул ДНК. РНК 1. Состав РНК УГЛЕВОД – рибоза (пятиуглеродный сахар) АЗОТИСТОЕ ОСНОВАНИЕ – аденин, урациил, гуанин, цитозин ОСТАТОК ФОСФОРНОЙ КИСЛОТЫ 2. Структура РНК РНК состоит из одной полинуклеотидной цепи; Связь между нуклеотидами в цепи РНК – ковалентные связи между гидроксильной группой рибозы одного нуклеотида и остатком фосфорной кислоты другого нуклеотида; 3. Виды РНК: информационная РНК (и-РНК) или матричная РНК (м-РНК) транспортная РНК (т-РНК) рибосомная РНК (р-РНК) 4. Информационная РНК Составляет около 5% от всех РНК клетки; Структура: незамкнутая цепь, содержащая от 300 до 30000 нуклеотидов; является комплементарной копией определенного участка ДНК (гена); Функции: переносит информацию о первичной структуре определенного белка от ДНК к рибосомам; является матрицей для синтеза этого белка. 5. Транспортная РНК Составляет 15% от всех РНК клетки; Структура: содержит 75-85 нуклеотидов, молекула т-РНК имеет вторичную структуру в форме «клеверного листа» (из-за наличия водородных связей) и два активных участка: антикодон – триплет нуклеотидов на верхушке «клеверного листа», антикодон комплементарен одному из кодонов и-РНК; антикодон определяет, какую АК будет переносить данная т-РНК; и акцепторный конец – к нему присоединяются аминокислоты, которые переносит данная тРНК; Функция т-РНК – транспорт АК в рибосому к месту синтеза белка. 6. Рибосомная РНК Составляет до 85% от всех РНК клетки; Место синтеза: молекулы р-РНК синтезируются на участках ДНК хромосом, расположенных в ядрышковом центре ядра; Локализация: в комплексе с белками образует рибосомы – органеллы, на которых происходит синтез белка; Скопление р-РНК и рибосом представляют собой ядрышки. Функция – синтез белка. 7. ВИРУСНЫЕ РНК Самые высокомолекулярные из всех видов РНК; Они несут информацию о структуре вируса, т.е. являются его генетическим аппаратом АТФ Аденозинтрифосфорная кислота (АТФ) – органическое вещество, выполняющее роль аккумулятора энергии в клетке в виде макроэргических связей. Строение молекулы АТФ: мононуклеотид; состав: углевод – рибоза, азотистое основание – аденин, три остатка фосфорной кислоты. Энергетика химических связей: между остатками фосфорной кислоты существуют макроэргические связи; при разрыве одной такой связи в результате гидролитического (под воздействием молекулы воды) отщепления молекулы фосфорной кислоты выделяется 40 кДж энергии; АТФ + Н2О = АДФ + Н3РО4 + 40 кДж АДФ + Н2О = АМФ + Н3РО4 + 40 кДж макроэргические связи обозначаются волнистой чертой ( синтез АТФ происходит за счет энергии, освобождающейся при окислении органических веществ (окислительное фосфорилирование) Некоторые особенности АТФ АТФ синтезируется в митохондриях и хлоропластах (у растений в процессе фотосинтеза); Среднее время жизни молекулы АТФ в клетке – менее 1 мин. Значение АТФ: Главный и универсальный источник энергии для всех процессов жизнедеятельности клетки. ОСНОВНОЙ ВЫВОД ПО ХИМИЧЕСКОМУ СОСТАВУ КЛЕТОК: СХОДСТВО СТРОЕНИЯ И ХИМИЧЕСКОГО СОСТАВА КЛЕТОК ВСЕХ ОРГАНИЗМОВ ЯВЛЯЕТСЯ ОСНОВОЙ ЕДИНСТВА ОРГАНИЧЕСКОГО МИРА, ДОКАЗАТЕЛЬСТВОМ РОДСТВА.









