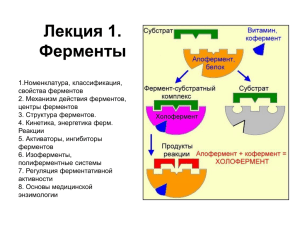
КАТАЛИЗАТОРЫ И ФЕРМЕНТЫ Выполнила: Пулатова Б. Ф Принял: Цуканов М. Н ПЛАН: Катализаторы Общие свойства катализаторов Ферменты ◦ Определение понятия «фермент». ◦ Строение ферментов. ◦ Номенклатура ферментов и их классификация. ◦ Механизм действия ферментов. ◦ Кинетика действия ферментов. ◦ Единицы ферментативной активности. ◦ Общие свойства ферментов. Термолабильность и влияние рН. Катализаторы Катализом называется процесс, который происходит в присутствии веществ, которые изменяют скорость реакции. Катализатор - это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется. Катализаторами могут быть самые разнообразные органические и неорганические соединения, находящиеся в любом агрегатном состоянии. Количество катализатора участвующего в реакции мало, и как правил, остается постоянным. Общие свойства катализаторов Важным свойством катализатора есть то, что он не влияет на константу равновесия реакции. В связи с этим катализатор может изменить скорость достижения равновесия, но не смещать его. Поэтому при наличии катализатора не удается получить в равновесной системе большего количества продуктов реакции, чем при его отсутствии. Реакции, протекающие в присутствии катализаторов, особенно ферментов, требуют меньшей энергии активации E: 1) некаталитические реакции: E = 30000 -45000 кал/г моль; 2) каталитические реакции: E = 16000 30000 кал/ г моль; 3) ферментативные реакции: E = 800012000 кал/ г моль. Факторы, влияющие на катализ Факторы, влияющие на каталитические процессы, по существу являются теми же, что и факторы, влияющие на скорость химических реакций. Влияние температуры. Повышение температуры увеличивает скорость каталитических процессов, а также может влиять на направление реакции и на активность катализатора. Каждый катализатор в зависимости от его свойств проявляет максимальную активность в катализируемой им реакции при строго определенной температуре. Повышение температуры, изменяющее оптимальные условия действия катализатора, уменьшает их активность. Увеличение температуры, особенно влияет на ферментативные реакции, так как ферменты по природе белки, то при увеличении температуры он денатурируют. Влияние давления. Скорость некоторых каталитических реакций значительно изменяется при процессах, протекающих с изменением давления. Многие каталитические реакции в условиях нормального давления не протекают (например, синтез высших спиртов). Увеличение давления ускоряет химические процессы, потому что увеличивается число активных столкновений реагирующих молекул. Ферменты Определение понятия «фермент». Ферменты - биологические катализаторы белковой природы, образуемые живой клеткой, действующие с высокой активностью и специфичностью. Термин «фермент» происходит от лат. fermentatio брожение или «fermentum» - закваска. Ферменты еще называют «энзимами» от греч. еnzyme - в дрожжах, т.к. первые представления об этих веществах были связаны со способностью дрожжей сбраживать сахар в вино. По строению ферменты могут быть: 1. ОДНОКОМПОНЕНТНЫЕ (ПРОСТЫЕ БЕЛКИ), 2. ДВУХКОМПОНЕНТНЫЕ (СЛОЖНЫЕ БЕЛКИ). К ферментам простым белкам относятся пищеварительны е ферменты (пепсин, трипсин). К ферментам сложным белкам - можно отнести ферменты, катализирующие окислительновосстановительн ые реакции. ДЛЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ДВУХКОМПОНЕНТНЫХ ФЕРМЕНТОВ НЕОБХОДИМ ДОПОЛНИТЕЛЬНЫЙ ХИМИЧЕСКИЙ КОМПОНЕНТ, КОТОРЫЙ НАЗЫВАЕТСЯ КОФАКТОР. Роль кофактора могут играть как неорганические вещества (ионы железа, магния, цинка, меди и др.), так и органические вещества - коферменты (например, активные формы витаминов). Для работы ряда ферментов необходимы и кофермент, и ионы металлов (кофактор). Коферменты - низкомолекулярные органические вещества небелковой природы, связанные с белковой частью фермента временно и непрочно. Активный центр ферментов представляет ту часть молекулы фермента, к которой присоединяется субстрат (химическое вещество, которое подвергается катализу) и от которой зависят каталитические свойства молекулы фермента. В активном центре фермента выделяют «контактный, якорный, субстратный» участок - участок, притягивающий и удерживающий субстрат на ферменте благодаря своим функциональным группам и «каталитический» участок, функциональные группы которого непосредственно участвуют в каталитической реакции. Аллостерический центр. У некоторых ферментов, кроме активного центра, имеется еще «другой» центр аллостерический. С аллостерическим центром взаимодействуют различные вещества (эффекторы), чаще всего различные метаболиты. Соединение этих веществ с аллостерическим центром приводит к изменению конформации фермента (третичной и четвертичной структуры). Активный центр в молекуле фермента либо создается, либо он нарушается. В первом случае реакция ускоряется, во втором случае тормозится. Поэтому аллостерический центр называют регуляторным центром фермента. Ферменты, имеющие в своей структуре аллостерический центр, называются регуляторными или аллостерическими. Номенклатура и классификация ферментов. Современная классификация ферментов основана на природе катализируемых ими химических превращений. В основу классификации берется тип реакции, катализируемой ферментом. Ферменты разделяют на 6 классов: 1. Оксидоредуктазы - катализируют окислительновосстановительные реакции 2. Трансферазы - перенос групп 3. Гидролазы - гидролиз 4. Лиазы - негидролитическое расщепление субстрата 5. Изомеразы - изомеризация 6. Лигазы (синтетазы)- синтез с использованием энергии (АТФ) Номенклатура ферментов. 1. Тривиальное название (пепсин, трипсин). 2. Название фермента может складываться из названия субстрата с прибавлением окончания «аза» (аргиназа гидролизует аминокислоту аргинин). 3. Добавление окончания «аза» к названию катализируемой реакции (гидролаза катализирует гидролиз, дегидрогеназа - дегидрирование органической молекулы, т.е. отнятие протонов и электронов от субстрата). 4. Рациональное название - название субстратов и характер катализируемых реакций (АТФ + гексоза гексозо-6-фосфат + АДФ. Фермент: АТФ: ^-гексоза-6фосфотрансфераза). 5. Индексирование ферментов (каждому ферменту присваиваются 4 индекса или порядковых номера): 1.1.1.1 - АДГ, 1.1.1.27 - ЛДГ. Механизм действия ферментов. В основу теории механизма действия ферментов положено образование фермент-субстратного комплекса. Механизм действия фермента, исходя из работ Брауна, Михаэлиса и Ментен можно представить поэтапно: 1. образование фермент-субстратного комплекса (субстрат прикрепляется к активному центру фермента). 2. на второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (Еп) и субстрат (8) начинают сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный комплекс. 3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования ферментсубстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне. КИНЕТИКА ДЕЙСТВИЯ ФЕРМЕНТОВ. На ход ферментативной реакции оказывают влияние различные факторы окружающей среды: температура, реакция среды, самые разнообразные вещества, имеющиеся в живой клетке. Все эти факторы можно рассматривать как факторы регуляции ферментативных процессов. Об активности фермента судят по скорости ферментативной реакции. Скорость реакции определяется либо по уменьшению количества субстрата, либо по увеличению количества продукта реакции за единицу времени. Об изменениях количества субстрата и продукта узнают, применяя колориметрические, манометрические, поляриметрические, хроматографические и другие методы. Влияние концентрации субстрата. Зависимость скорости ферментативной реакции от концентрации субстрата выражается гиперболической кривой (см. наглядный материал). При низких концентрациях субстрата скорость реакции пропорциональна концентрации субстрата. По мере увеличения концентрации субстрата активные центры молекул фермента взаимодействует с молекулами субстрата до полного насыщения активных центров всех молекул фермента. Когда активные центры всех молекул фермента связаны с субстратами, скорость ферментативной реакции максимальна. Дальнейшее увеличение концентрации субстрата не приводит к увеличению скорости реакции. Л. Михаэлис и М. Ментен предложили, используя график зависимости скорости реакции от концентрации субстрата, определять константу Михаэлиса (Кт). Константа Михаэлиса - это такое количество субстрата, при котором скорость ферментативной реакции равна половине от максимальной. Влияние концентрации фермента. Скорость ферментативной реакции прямо пропорциональ на концентрации фермента: V = [Р]*К, где К - константа скорости реакции, [Р] -концентрация фермента (см. наглядный материал). Единицы ферментативной активности. Международной единицей (МЕ) активности ферментов является количество фермента, способного превратить 1 мкмоль субстрата в продукты реакции за 1 мин при 25 °С и оптимуме рН. Катал соответствует количеству катализатора, способного превращать 1 моль субстрата в продукт за 1 сек при 25 °С и оптимуме рН. Удельная активность фермента - число единиц ферментативной активности фермента в расчете на 1 мг белка. Молярная активность - это отношение числа единиц ферментативной активности каталов или МЕ к числу молей фермента. Общие свойства ферментов характеризуют ферменты как катализаторы белковой природы. К общим свойствам ферментов относятся: 1. Термолабильность (влияние температуры). 2. Влияние рН 3. Специфичность Влияние температуры (термолабильно сть). Ферменты не устойчивы к температурному воздействию. Влияние температуры на ферментативный процесс подчиняется правилу ВантГоффа: при увеличении температуры на 10°С скорость ферментативной реакции возрастает в 2 - 4 раза. Оптимальной температурой для действия ферментов организма человека является температура 37-40°С. Снижение ферментативной активности наблюдается при низких температурах, но при этом не происходит потери биологических свойств фермента. При повышении температуры выше 45°С начинается постепенное нарушение активного центра фермента. Влияние рН. На ферментативную активность в значительной степени влияет концентрация протонов (величина рН). В сильнокислой или сильнощелочной среде у большинства ферментов происходит необратимая денатурация. Ферментативная реакция происходит наиболее активно при определенных значениях рН для каждого фермента. Такая величина рН, при которой скорость реакции является максимальной у данной ферментативной реакции, называется рНоптимумом фермента. Разные ферменты имеют разные оптимумы рН: пепсин - 1,5-2; амилаза - 6,8; трипсин - 8 и т.д.