ПР 13-14
реклама

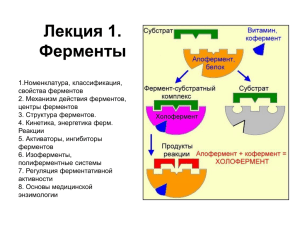
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ 1. ЭНЕРГЕТИЧЕСКИЕ ИЗМЕНЕНИЯ ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ. 2. ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА. 3. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА. Энергетические изменения при химических реакциях закон сохранения энергии общая энергия химической системы остаётся постоянной закон энтропии химическая система стремится к снижению упорядоченности Для понимания энергетики химической реакции недостаточно знать энергетический баланс входящих и выходящих из реакции реагентов, необходимо учитывать изменения энергии в процессе данной химической реакции и роль ферментов в динамике этого процесса H2CO3 → H2O + CO2 Еа - Энергия активации дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию Разница энергий между исходным реагентом и конечными соединениями - изменение свободной энергии реакции ΔG. ферменты не изменяют свободную энергию субстратов и продуктов и поэтому не меняют равновесие реакции ! Сходство ферментов с Отличия ферментов от небиологическими небиологических катализаторов : катализаторами: •скорость реакций реакций, • катализируют энергетически выше, чем катализируемых небелковыми катализаторами; возможные реакции; •ферменты • энергия химической системы специфичностью; остаётся постоянной; •реакция проходит в клетке, т.е. • в ходе катализа направление реакции не изменяется; • ферменты не расходуются в процессе реакции. обладают высокой при температуре 37ºС, постоянном атмосферном давлении и физиологическом значении рН; •скорость ферментативной реакции может регулироваться. экспериментальные методы определения скоростей реакций S→P V = - (ds/dt)=(dp/dt) (1) V выражается в числе молей в единице объема в единицу времени Скорость реакции является интенсивной величиной При экспериментальном изучении кинетики часто используют реакторы с эффективным перемешиванием • Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени: V= D[S]/t = D[P]/t При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента • одна международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Количество единиц активности nME определяют по формуле 1 катал (кат), соответствует такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле: Международная единица ферментативной активности МЕ связана с каталом следующими равенствами • 1 кат = 1 моль S/с = 60 моль S/мин = = 60х106 мкмоль/мин = 6х107 МЕ, • 1 МЕ = 1 мкмоль/мин = 1/60 мкмоль/с 1 60 мккат = 16,67 нкат. В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - МЕ • Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nME) в образце ткани, делённому на массу (мг) белка в этой ткани. • По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.