Дз по химии к ноябрьским сборам
реклама
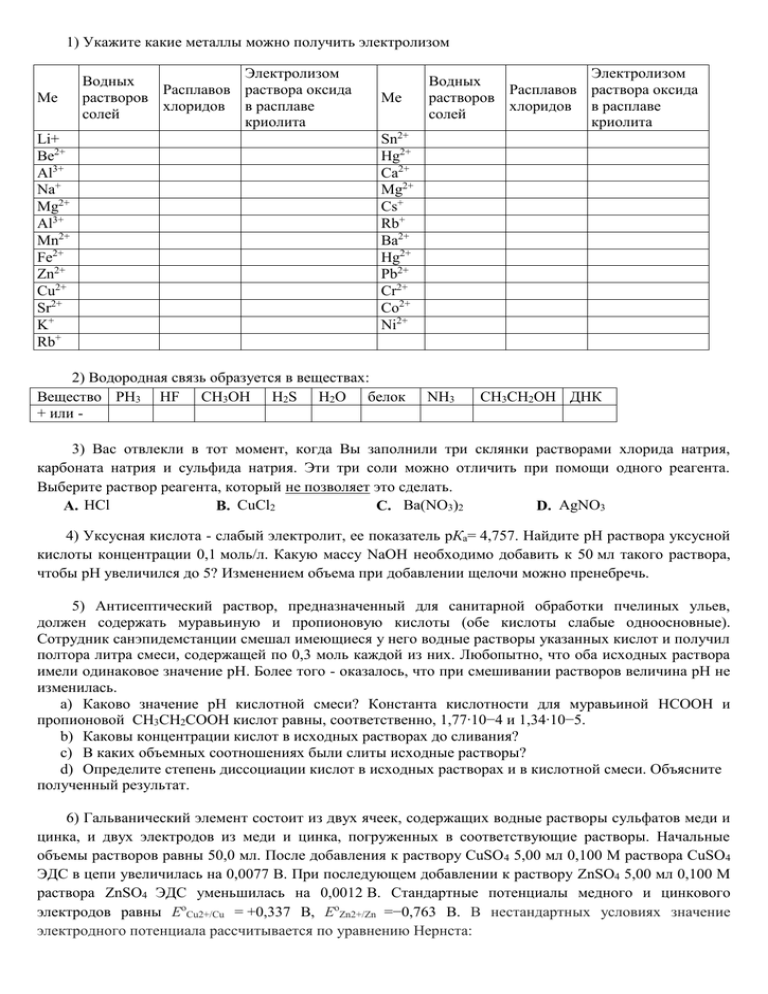
1) Укажите какие металлы можно получить электролизом Me Li+ Be2+ Al3+ Na+ Mg2+ Al3+ Mn2+ Fe2+ Zn2+ Cu2+ Sr2+ K+ Rb+ Электролизом Водных Расплавов раствора оксида растворов хлоридов в расплаве солей криолита Me Электролизом Водных Расплавов раствора оксида растворов хлоридов в расплаве солей криолита Sn2+ Hg2+ Ca2+ Mg2+ Cs+ Rb+ Ba2+ Hg2+ Pb2+ Cr2+ Co2+ Ni2+ 2) Водородная связь образуется в веществах: Вещество PH3 HF CH3OH H2S H2O белок + или - NH3 CH3CH2OH ДНК 3) Вас отвлекли в тот момент, когда Вы заполнили три склянки растворами хлорида натрия, карбоната натрия и сульфида натрия. Эти три соли можно отличить при помощи одного реагента. Выберите раствор реагента, который не позволяет это сделать. A. HCl B. CuCl2 C. Ba(NO3)2 D. AgNO3 4) Уксусная кислота - слабый электролит, ее показатель рКа= 4,757. Найдите рН раствора уксусной кислоты концентрации 0,1 моль/л. Какую массу NaOH необходимо добавить к 50 мл такого раствора, чтобы рН увеличился до 5? Изменением объема при добавлении щелочи можно пренебречь. 5) Антисептический раствор, предназначенный для санитарной обработки пчелиных ульев, должен содержать муравьиную и пропионовую кислоты (обе кислоты слабые одноосновные). Сотрудник санэпидемстанции смешал имеющиеся у него водные растворы указанных кислот и получил полтора литра смеси, содержащей по 0,3 моль каждой из них. Любопытно, что оба исходных раствора имели одинаковое значение рН. Более того - оказалось, что при смешивании растворов величина рН не изменилась. a) Каково значение рН кислотной смеси? Константа кислотности для муравьиной НСООН и пропионовой СН3СН2СООН кислот равны, соответственно, 1,77∙10−4 и 1,34∙10−5. b) Каковы концентрации кислот в исходных растворах до сливания? c) В каких объемных соотношениях были слиты исходные растворы? d) Определите степень диссоциации кислот в исходных растворах и в кислотной смеси. Объясните полученный результат. 6) Гальванический элемент состоит из двух ячеек, содержащих водные растворы сульфатов меди и цинка, и двух электродов из меди и цинка, погруженных в соответствующие растворы. Начальные объемы растворов равны 50,0 мл. После добавления к раствору CuSO 4 5,00 мл 0,100 М раствора CuSO4 ЭДС в цепи увеличилась на 0,0077 В. При последующем добавлении к раствору ZnSO4 5,00 мл 0,100 М раствора ZnSO4 ЭДС уменьшилась на 0,0012 В. Стандартные потенциалы медного и цинкового электродов равны ЕоCu2+/Cu = +0,337 В, ЕоZn2+/Zn =−0,763 В. В нестандартных условиях значение электродного потенциала рассчитывается по уравнению Нернста: 𝐸 = 𝐸о + Произведение возведнных в соответсвующие степени концентраций окисленных форм ln Произведение возведнных в соответсвующие степени, 𝑛𝐹 концентраций восстановленных форм 𝑅𝑇 где R – газовая постоянная; T – температура (К); n – число электронов, перешедших от окисленной формы вещества к восстановленной; F – число Фарадея (96500 Кл/моль). Если полуячейка n+ представляет собой пару Me /Me, то активность твердого металла принимается за единицу, и уравнение Нернста упрощается: 𝑅𝑇 𝑅𝑇 𝐸 = 𝐸 о + 𝑛𝐹 ln[Me𝑛+ ] = 𝐸 о + 2,303· 𝑛𝐹 lg[Me𝑛+ ] a) Напишите уравнения процессов, протекающих на электродах. b) Рассчитайте ЭДС элемента, содержащего растворы 0,01 М ZnSO4 и 0,05 М СгSO4. c) Определите начальные концентрации солей меди и цинка.Найдите значение ЭДС после добавления растворов. 7) Студент для определения произведения растворимости хлорида серебра воспользовался прибором, изображенном на рис. Измеренное значение ЭДС оказалось равным 0,11 В. 𝐸 = 𝐸 о + 0,0592 ∙ lg[Ag + ] 0 𝐸Ag + /Ag = +0,80 В a) Используя приведенное выше уравнение, выведите уравнение для ЭДС, полученной в эксперименте. b) Напишите диаграмму ячейки. c) Вычислите концентрацию хлорид-ионов в правой полуячейке. d) Напишите выражение для произведения растворимости хлорида серебра и вычислите его значение; для чего правая полуячейка содержит твердый хлорид серебра?











