Основания. Состав. Классификация Химические свойства оснований
реклама

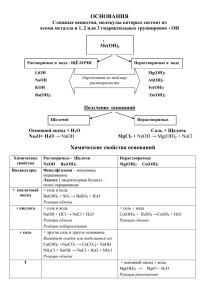
Основания. Состав. Классификация Химические свойства оснований Презентацию составила Кирова С.Ю.-учитель химии МОУ «СОШ №3 с углубленным изучением музыкальных предметов им. А.П. Иванова» г. Бежецка Тверской обл. Состав оснований. Классификация 1) По количеству гидроксогрупп Ме(ОН)n ↙ MeOH ↓ Me(OH)2 где n=1,2,3 ↘ Me(OH)3 Число гидроксогрупп определяется степенью окисления металла (+1) КОН, NaOH, (+2) Ca(OH)2, Ba(OH)2 (+3) Al(OH)3, Fe(OH)3 2)По растворимости в воде Ме(ОН)n ↙ Сильные электролиты Растворимые в воде(щелочи) (Основания активных Ме) КОН, NaOH, Ca(OH)2, Ba(OH)2 ↘ Слабые электролиты нерастворимые в воде ( Основания остальных Ме) Mg(OH)2, Cu(OH)2,Fe(OH)2 Получение оснований растворимых Ме(акт)+НОН→Ме(ОН)n+Н2 МехОy(акт)+Н2О→ Ме(ОН)n эаписать уравнения самостоятельно нерастворимых Соль(рр)+щелочь→Основание↓+соль СuCl2+2NaOH→Cu(OH)2+2NaCl Химические свойства оснований 1)Растворы щелочей изменяют окраску индикаторов(см.таблица4,стр70) NaOH→Na++OH- KOH→K++OHBa(OH)2→(записать ур-ие диссоциации) Нейтральная среда Лакмус Метилоранж Фенолфталеи н Кислая среда Щелочная среда 2)Взаимодействие оснований с кислотами ( общее свойство для растворимых и нерастворимых оснований) ОСНОВАНИЕ + КИСЛОТА → СОЛЬ + ВОДА а) NaOH+HCl→NaCl+H2O –уравнение реакции нейтрализации б) Cu(OH)2+2HNO3→Cu(NO3)2+2H2O Свойства щелочей 2)Взаимодействие с кислотными оксидами: Ca(OH) +CO →CaCO +H O 2 2 3 2 3) Взаимодействие с растворами солей MgCl +2 КOH→Mg(OH) +2 KCl 2 2 NaOH+ CO → 2 KOH+P O → 2 5 CuSO +NaOH→ 4 FeI +KOH→ 2 Свойства нерастворимых оснований 3)Разложение нерастворимых оснований: Cu(OH) → CuO + H O 2 2 Mg(OH) → 2 Fe(OH) → 2 Закрепление: №3(в,д,е), стр162 Домашнее задание: §39, конспект урока .№3(а,б,г), №5 стр162 Используемые сайты: • [url=http://sc.karelia.ru/catalog/rubr/8f5d721 0-86a6-11da-a72b• http://cor.edu.27.ru/dlrstore/3707d1a9-5056e94f-c2b0-64a30553f74f/039.gif • http://www.ru.all.biz/buy/goods/?group=100 1167&page=4 • http://dmir.ru/msk/business/wholesale/1119 754/






![основание2 [восстановлен]](http://s1.studylib.ru/store/data/005094447_1-44f86856ce2d4ba2c8d6e45b04a264f9-300x300.png)