"ЕНТ" (Успенская В.А) - Отдел образования г.Рудного
реклама

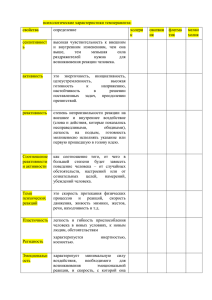
Слагаемые успеха Мотивация учащегося. Уровень подготовки ученика. Работа учителя с учеником. Работа психологической службы. Поддержка родителей. Работа учителя Мониторинг. Выявление западающих тем ( по тестам ЕНТ, собеседование, контрольные работы). Составление плана работы по западающим темам( по четвертям) с коррекцией плана. Индивидуальные, коррекционные и дополнительные занятия. Создание банка тестовых и проверочных заданий. Работа ученика по подготовке к ЕНТ 1.Самостоятельн ая работа ученика. 2. Работа с различными источниками знаний. 3. Работа с тестами ЕНТ. 4. Работа во взаимодействии с учителем ( дополнительные , коррекционные задания). Мониторинговая карта ошибок по основным темам № Название темы 1 Основные химические понятия 2 Пери одический закон и система 3 Химическая связь и строение вещества Название подтемы 1. 2. 3. 1. 2. 3. Основные понятия и законы Типы химических реакций Расчеты по формулам Строение атома Периодическая система Положение элемента и его характер 1. Виды хим связи 2. О- В процессы Дата - - - - 4 5 6 Закономерности протекания химических реакций Теория электролитической диссоциации Основные классы неорганических соединений 7 Генетическая связь между классами 8 Металлы 1. Скорость хим. реакций 2. Хим равновесие 1. Диссоциация 2. Реакции ионного обмен 3. Гидролиз солей 1. Оксиды 2. Основания 3. Кислоты 4. Соли Генетические цепочки Электролиз - - - - -- - --- План работы по западающим темам № Название западающих тем 1 2 3 4 5 Генетические цепочки неорганических веществ Электролиз ( лекция) Работа ученицы Самостоятельна я работа ученицы по заданиям Взаимодействие конц кислот: данных тем с серной и азотной с металлами последующей Скорость реакции (лекция) проверкой и корректировкой ЭХРНМ План коррекционной работы индивидуальн ые занятия – составление с учеником схемы всех видов электролиза; задания по составлению уравнений электролиза; решение задач по электролизу; подборка задач по электролизу в сборниках ЕНТ для самостоятель ного решения; Схема электролиза расплавов солей Металлов (Li ↔Mg) MeCl ↔ Me+ + Cl K- Me+ + e → Me0 A+ Cl- - e → Cl0 2Cl0 → Cl20 MeCl → Me0 + Cl20↑ Металлов правее Al MeCl ↔ Me+ + Cl K- Me+ + e → Me0 A+ Cl- - e → Cl0 2Cl0 → Cl20 MeCl → Me0 + Cl20↑ Схема электролиза растворов солей Металлов (Li ↔Mg) MeSO4 ↔ Me+ + SO42 K- 2H2O + 4e → H2 +2OH A+ 2H2O – 4e → O20 + 4H+ MeSO4 + 4H2O → H20↑ + H2SO4 + MeOH + O20↑ Металлов правее Al MeSO4 ↔ Me+ + SO42 K- Me+ + e → Me0 A+ 2H2O – 4e → O20 + 4H+ MeSO4+ 2 H2O → Me0 + H2SO4 + O20↑ Работа ученицы по западающей теме «Электролиз» Задачи по электролизу. 1 • При электролизе 170г 50% раствора нитрата серебра получено 43,2 г серебра. Выход продукта реакции составляет? 2 • Отношение массы полученного металла к массе газообразного продукта в уравнении электролиза раствора нитрата серебра? 3 • Простейшее мольное соотношение продуктов реакции к исходным веществам в молекулярном уравнении электролиза водного раствора нитрата меди. Результаты пробного ЕНТ у Малышевой Анастасии 2015 уч г дата 20.09 11.10 20.12 31.01 7.02 11.04 18.04 16.05 итог балл 9 11 14 15 18 17 22 20 20 % 0 0 100 100 100 100 100 100 100 кач % 100 100 100 100 100 100 100 100 100 успе в оцен 3 3 4 4 4 4 5 5 5 ка Результаты ЕНТ Знания и умения формируемые для успешной сдачи ЕНТ. составление формул по валентности; номенклатура химических соединений; характеристика элемента по его положению в ПСХЭ; составление уравнений химических реакций; расстановка коэффициентов в уравнениях ; расчеты по уравнениям реакций; составление генетических цепочек и уравнений реакций по ним; составление окислительно - восстановительных уравнений; определение степени окисления элементов; записывать молекулярные, полные и сокращенные уравнения реакций; определять класс соединений; химические свойства каждого класса неорганических и органических веществ; качественные реакции; определять тип химической реакции.