HNO Азотная кислота 3
реклама

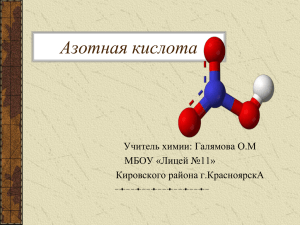
Азотная кислота HNO3 СОДЕРЖАНИЕ: 1. Строение 2. Получение: а) в лаборатории б) в промышленности 3. Физические свойства 4. Химические свойства, общие с другими кислотами 5. Химические свойства, специфические 6. Применение Строение HNO3 О N Н О Степень окисления атома N: Валентность атома N: О +5 ІV Кристаллическая решётка: молекулярная Вид связи: ковалентная полярная Получение HNO3 В лаборатории NaNO3 + H2SO4 нитрат натрия серная кислота t NaHSO4 + HNO3 гидросульфат натрия азотная кислота Получение HNO3 в промышленности а) 4 NH3 + 5 O2 = 4 NO +6 H2O аммиак оксид азота(ІІ) б) 2 NO + O2 = 2 NO2 оксид азота(ІV) в) 4 NO2 + 2H2O + O2 = 4HNO3 азотная кислота Физические свойства ρ= 1,52 г/см3 ХИМИЧЕСКИЕ СВОЙСТВА, ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ 1.Сильный электролит, хорошо диссоциирует на ионы: HNO3 = H+ +NO3лакмус- красный 2. Реагирует с основными оксидами: СuO + 2 HNO3 = Cu(NO3)2 + H2O оксид меди (ІІ) нитрат меди (ІІ) 3. Реагирует с основаниями: HNO3 + KOH = KNO3 + H2O гидроксид калия нитрат калия 4. Реагирует с солями более слабых кислот )2+H2CO3 СaCO3 +2 HNO3 = Сa(NO 3 нитрат угольная карбонат кальция кальция кислота Н2O СO2 СПЕЦИФИЧЕСКИЕ ХИМИЧЕСКИЕ СВОЙСТВА 5. При нагревании и под действием света разлагается: 4 HNO3 =4 NO2 +2 H2O + O2 6. Специфически взаимодействует с металлами – никогда не выделяется Н2 (продукты реакции зависят от активности металла и концентрации кислоты) 4 HNO 3 + Cu = Cu(NO3)2 + 2 NO2 + 2 H2O конц. 8 HNO3 +3 Cu = 3 Cu(NO3)2 + 2 NO + 4 H2O 18HNO3 +8 Zn = 8 Zn(NO3)2 +2 NH3 + 6 H2O 7. HNO3 - сильнейший окислитель: реагирует с неметаллами 5 HNO 3 +3 Р = 3 НРO3 + 5NO + H2O конц. метафосфорная кислота Селитры – соли(нитраты) щелочных, щелочноземельных металлов и аммония: KNO3 калийная селитра NaNO3 натриевая селитра NH4NO3 аммиачная селитра Азотная кислота широко используется для производства азотных удобрений, искусственных волокон, органических красителей, лаков и взрывчатых веществ. Проверь себя: Закончите высказывания: 1. Формула азотной кислоты ... 2. Ее получают в промышленности из ... 3. Укажите степень окисления азота … и валентность … в азотной кислоте. 4. Азотная кислота является... электролитом и взаимодействует с ...; …;…; 5. Особым свойством азотной кислоты является взаимодействие с .... При данных реакциях газ ... никогда не выделяется. 6. Соли азотной кислоты - .... 7. Соли щелочных, щелочноземельных металлов и аммония называются … 8. Соли азотной кислоты используются как .... 9. Азотная кислота применяется для получения… ОТВЕТЫ 1. Формула азотной кислоты HNO3 2. Ее получают в промышленности из аммиака. 3. Укажите степень окисления азота + 5 и валентность ІV в азотной кислоте. 4. Азотная кислота является сильным электролитом и взаимодействует с основными оксидами; основаниями; солями более слабых кислот; 5. Особым свойством азотной кислоты является взаимодействие с металлами. При данных реакциях газ Н2 никогда не выделяется. 6. Соли азотной кислоты - нитраты. 7. Соли щелочных, щелочноземельных металлов и аммония называются селитрами. 8. Соли азотной кислоты используются как удобрения. 9. Азотная кислота применяется для получения азотных удобрений, искусственных волокон, органических красителей, лаков и взрывчатых веществ. С начала