Документ 4985937
реклама

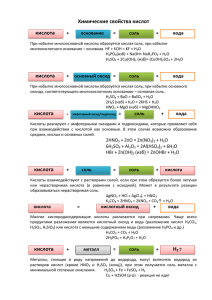
это соединения, состоящие из атомов водорода и кислотного остатка HCl Хлороводородная кислота HF Фтороводородная кислота H2SO4 Соляная кислота Плавиковая кислота Серная кислота Сульфат водорода Кислородсодержащие Одноосновные: HNO3 Двухосновные: H2SO4, H2CO3, H2SiO3 Трехосновные: Н3РО4 Бескислородные Одноосновные: HCL, HBr, HF, HJ Двухосновные: H2S Р2О5 + 3Н2О = 2Н3РО4 SO3 + Н2О = H2SO4 NaNO3 + H2SO4(конц.) = NaHSO4 + HNO3 Нитрат натрия Гидросульфат натрия NaCL + H2SO4(конц.) = NaHSO4 + HCL Гидросульфат натрия H2 + CL2 = 2HCL H2 + S2 = H2S 1. Взаимодействуют с металлами, стоящими в ряду напряжения до водорода: Fe + 2HCl = FeCl2 + H2↑ 2. Взаимодействуют с основными оксидами: FeO + 2HCl = FeCl2 + H2O 3. Между кислотой о основанием протекает реакция нейтрализации: Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O 4. Кислоты с солями вступают в реакцию обмена: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ Основание = Соль + Вода Основной оксид = Соль + Вода Металлы = от Mg до Pb Соль + Водород + Кислота + (кроме HNO3) + Соли = Новая (карбонаты, соль сульфиты) + Вода + Газ сложные вещества, молекулы которых состоят из атомов металла и кислотного остатка Продукт, который образуется в результате неполного замещения атомов водорода в молекулах кислот на атомы металлов или гидроксогрупп в молекулах оснований кислотными остатками Средние Кислые Основные KHSO4, Mg(OH)CL Na3PO4 Гидросульфат Гидроксохлорид магния фосфат натрия калия K2CO3 NaH2PO4 карбонат калия дигидрофосфа т натрия образуются при замещении всех атомов водорода в кислоте на атомы металла: KNO3, K3PO4 образуются при неполном замещении атомов водорода на атомы металла: NaHCO3, CaHPO4 образуются при неполном замещении гидроксидных групп кислотными остатками в молекулах основания: Zn(OH)CL, AL(OH)SO4 1. Взаимодействие металла с неметаллом: Mg + CL2 = MgCL2 2. Взаимодействие основных оксидов с кислотными оксидами: MgO + SO2 = MgSO3 3. Взаимодействие основных оксидов с кислотами: CaO + 2HCL = CaCL2 + H2O 4. Взаимодействие основных оксидов с основаниями: CO2 + Ca(OH)2 = CaCO3 + H2O 5. Взаимодействие кислот с основаниями (реакция нейтрализации): H2SO4 + 2NaOH = Na2SO4 + 2 H2O 6. Взаимодействие cолей и кислот с образованием новых солей: Na2CO3 + H2SO4 = Na2SO4 +H2O + CO2 ↑ 7. Взаимодействие cолей между собой с образованием новых солей: NaCL + AgNO3 = NaNO3 + AgCL↓ 8. Взаимодействие щелочей с солями с образованием нерастворимых оснований и новых солей: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ 9. Взаимодействие кислот с металлами, стоящими в ряду активности перед водородом: Zn + 2HCL = ZnCL2 + H2↑ 10. Взаимодействие металлов с солями с образованием металла и новой соли: Cu + HgCL2 = CuCL2 + Hg 1. Взаимодействие солей с металлами: Zn + Hg(NO3)2 = Zn(NO3)2 + Hg 2. Взаимодействие солей со щелочами: CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓ 3. Соли взаимодействуют с кислотами: CuSO4 + H2S = CuS↓ + H2SO4 4. Взаимодействие солей между собой: CaCl2 + Na2CO3= CaCO3↓ + 2NaCl 5. Некоторые соли разлагаются при нагревании: t CaCO3 = CaO + CO2↑ Щелочь = Новая соль + Металл = Новая соль + Кислота = Новая соль Соль = Новая соль Нерастворимое основание ↓ + Соли Металл + + Вода + Газ + + Нерастворимая соль • • • • § 47 прочитать; Стр. 127 № 7-11. § 48 прочитать; Стр. 131 № 8-10.