Химические свойства кислот кислота кислота кислота кислота
реклама
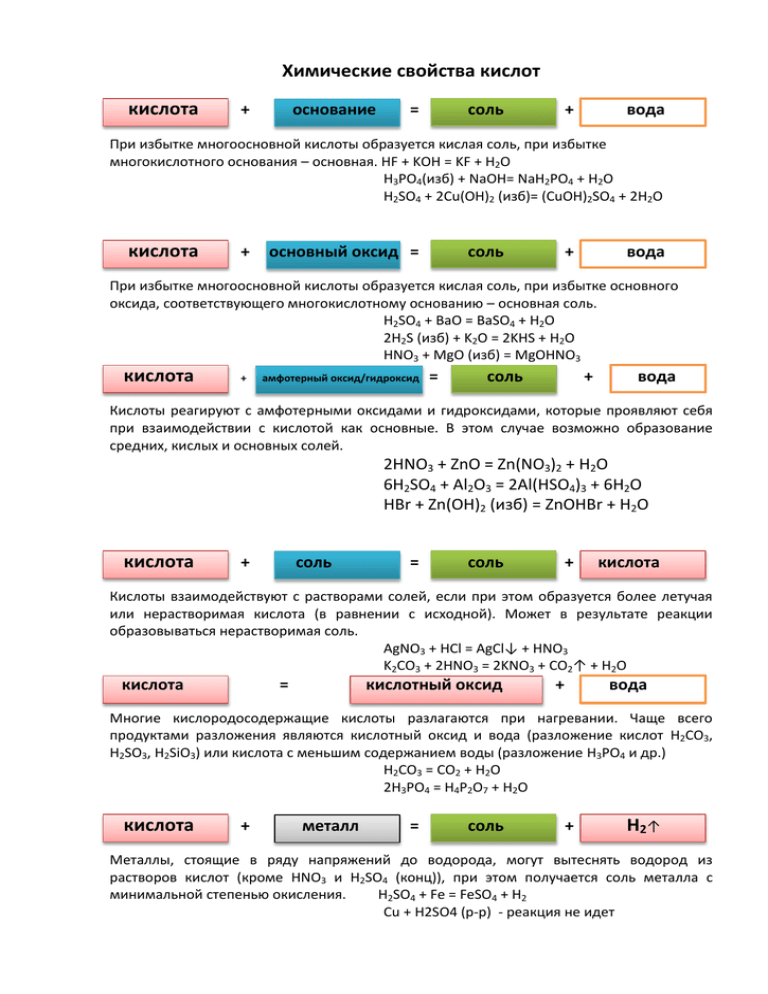
Химические свойства кислот кислота + основание = соль + вода При избытке многоосновной кислоты образуется кислая соль, при избытке многокислотного основания – основная. HF + KOH = KF + H2O H3PO4(изб) + NaOH= NaH2PO4 + H2O H2SO4 + 2Cu(OH)2 (изб)= (CuOH)2SO4 + 2H2O кислота + основный оксид = соль + вода При избытке многоосновной кислоты образуется кислая соль, при избытке основного оксида, соответствующего многокислотному основанию – основная соль. H2SO4 + BaO = BaSO4 + H2O 2H2S (изб) + K2O = 2KHS + H2O HNO3 + MgO (изб) = MgOHNO3 кислота + амфотерный оксид/гидроксид = соль + вода Кислоты реагируют с амфотерными оксидами и гидроксидами, которые проявляют себя при взаимодействии с кислотой как основные. В этом случае возможно образование средних, кислых и основных солей. 2HNO3 + ZnO = Zn(NO3)2 + H2O 6H2SO4 + Al2O3 = 2Al(HSO4)3 + 6H2O HBr + Zn(OH)2 (изб) = ZnOHBr + H2O кислота + cоль = соль + кислота Кислоты взаимодействуют с растворами солей, если при этом образуется более летучая или нерастворимая кислота (в равнении с исходной). Может в результате реакции образовываться нерастворимая соль. AgNO3 + HCl = AgCl↓ + HNO3 K2CO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O кислота = кислотный оксид + вода Многие кислородосодержащие кислоты разлагаются при нагревании. Чаще всего продуктами разложения являются кислотный оксид и вода (разложение кислот H2CO3, H2SO3, H2SiO3) или кислота с меньшим содержанием воды (разложение H3PO4 и др.) H2CO3 = CO2 + H2O 2H3PO4 = H4P2O7 + H2O кислота + металл = соль + H2 ↑ Металлы, стоящие в ряду напряжений до водорода, могут вытеснять водород из растворов кислот (кроме HNO3 и H2SO4 (конц)), при этом получается соль металла с минимальной степенью окисления. H2SO4 + Fe = FeSO4 + H2 Cu + H2SO4 (р-р) - реакция не идет







