Щелочные металлы Проект подготовила ученица Султанова Юлия
реклама

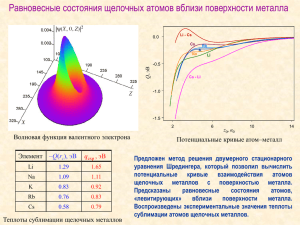
Щелочные металлы Проект подготовила ученица 11И класса Султанова Юлия Руководитель : Янгирова Ильзида Габдулкаюмовна Учитель МОУ СОШ №5 План урока : 1. Общая характеристика элементов 2. Характеристика группы 3. Получение металлов 4. Качественные реакции 5. Химические свойства 6. Соединение щелочных металлов 7.Рефлексия Общая характеристика элементов Очень мягкие металлы с малой плотностью, электроотрицательностью, потенциалом ионизации, низкими температурами кипения и плавления; чрезвычайно реакционноспособны, растворимы в жидком аммиаке, аминах, эфирах. Оксиды и гидроксиды – сильные основания. Характеристика группы : 1 группа, главная подгруппа. -Li -Na -K -Rb -Cs -Fr ns1 +1 степень окисления Увеличивается радиус и восстановительные свойства Получение металлов 1. Электролиз расплавов хлоридов и гидроксидов этих металлов : 4KOH=4K+O2+2H2O 2. Прокаливанием веществ: 2KF+CaC2=2K+2C+CaF2 Качественная реакция Окрашивание пламени Li-красное Na-желтое К-фиолетовое Химические свойства Взаимодействуют: С кислородом: 2Na +O2=Na2O2 С С серой : 2Na+ S=Na2S С азотом: 6Na+N2=2Na3N галогенами: 2 Na + Cl =2NaCl С водородом: 2Na+H2=2NaH С водой: 2Na+2H2O=2NaOH+H2 Соединение щелочных металлов Щелочи Me(OH) NaOH LiOH KOH Твердые кристаллические вещества, типично ионные соединения , сильные основания Соли щелочных металлов NaCl Na2SO4 K2CO3 Ионные соединения, хорошо растворимы в воде , растворимость растет от Li k Cs Задание: Закончите уравнение реакции: K + H2O= KOH+HCl = NaBr+ H2SO4= K+H2= K+O2= Задание: 1. Напишите уравнение реакции , происходящией при электролизе хлорида натрия? 2. Напишите уравнение реакции: Li----»LiOH----»LiCl----»Li2SO4 3. составить уравнения реакции с гидроксидом натрия