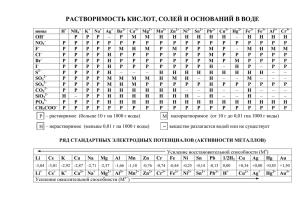
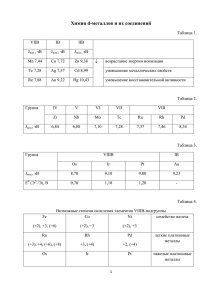
Ионно-электронный метод расстановки коэффициентов в
реклама

Ионно-электронный метод расстановки коэффициентов в окислительновосстановительных реакциях Метод полуреакций Учитель ГОУ СОШ № 424 Киселева Г.В. 1. В веществах, участвующих в реакции, определяют не степени окисления элементов, а заряды ионов: K+MnO4- + K+I- + H2+SO42- = Mn2+SO42- + I2 0 +K2+SO42- + H2O 2. Выбирают пары ионов, изменившиеся в ходе реакции: MnO4- → Mn2+ I→ I2 0 3. Уравнивают обе полуреакции по числу атомов каждого элемента (атомы кислорода – в составе воды) MnO4- + 8H+ → Mn2+ + 4H2O 2I- → I2 0 4.Уравнивают суммарные заряды в левой и правой частях каждой полуреакции, прибавляя или вычитая соответствующее число электронов: MnO4- + 8H+ + 5℮- → Mn2+ + 4H2O (1-и 8+ =7+ ) → ( 2+ и 0 = 2+) 2I- - 2℮- → I2 ( 2- ) → (0) 5. Уравнение каждой полуреакции умножают на такой множитель, чтобы число электронов в процессе восстановления было равно числу электронов в процессе окисления: MnO4- + 8H+ + 5℮- → Mn2+ + 4H2O | ×2 2I- - 2℮- → I2 0 |× 5 6. Уравнения обеих полуреакций почленно суммируют и получают сбалансированное уравнение полной реакции: MnO4- + 8H+ + 5℮- → Mn2+ + 4H2O ×2 2I- - 2℮- → I2 0 × 5 ______________________________ 10 I- + 2MnO4- + 16H+ = 5I2 + 2Mn2+ + 8H2O 7. Полученные коэффициенты записывают в основное уравнение перед соответствующими веществами: K+MnO4- + K+I- + H2+SO42- = Mn2+SO42- + I2 0 +K2+SO42- + H2O MnO4- + 8H+ + 5℮- → Mn2+ + 4H2O ×2 2I- - 2℮- → I2 0 × 5 _________________________________ 10 I- + 2MnO4- + 16H+ = 5I2 + 2Mn2+ + 8H2O 2KMnO4+ 10KI+ 8H2SO4 = 2MnSO4 + 5I2 +6K2SO4 + 8H2O