Лекция № 18
реклама

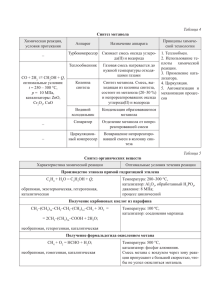
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ ТОПЛИВА И УГЛЕРОДНЫХ МАТЕРИАЛОВ Лекция № 18 СИНТЕЗЫ НА ОСНОВЕ ОКСИДОВ УГЛЕРОДА И ВОДОРОДА Синтезы на основе СО и Н2 Синтезы углеводородов из СО и Н2 – гетерогенно-каталитические процессы, протекающие с большим выделением тепла. Реакции могут протекать при атмосферном и повышенном давлениях в интервале температур 160–375 ºС, в зависимости от катализатора, используемого в процессе. Назначение синтез предельных углеводородов от газообразного метана до твёрдых высокоплавких парафинов; синтез спиртов от метанола до эйкозанола и выше [(СН3(СН2)19ОН – экойзаноловый спирт)]; синтез карбоновых кислот, сложных эфиров, альдегидов, кетонов; синтез олефинов. Сырье Практически из любого топлива (твёрдого, жидкого или газообразного) при газификации с водяным паром и кислородом можно получить смесь водорода и СО. Соотношение СО:Н2 можно изменять в любых необходимых пределах, выбирая условия газификации топлива или конверсии СО. Схема механизма Co CO+2H2 [–CH2–] + H2O –Н0 = –165,0 кДж/моль; 2CO + H2 Fe [–CH2–] + CO2 –Н0 = –207,9 кДж/моль; CH4 CH2= CnH2n n - CH2 - +H2 CnH2n+2 - CH2 - CH2 - (CH2)n-4- CH2 - CH2 - Для кобальтовых и никелевых катализаторов nCO+2nН2СnН2n+nН2О СnН2n+Н2 СnН2n+2 Для железных катализаторов 2nСО+2nН2СnН2n+nCО2 СnН2n+Н2 СnН2n+2 Механизм процесса на железном катализаторе Первоначальной стадией синтеза является одновременная хемосорбция СО и Н2 на катализаторе. Затем происходит образование первичного комплекса, приводящее к ослаблению связи С–О, что отличает образование первичного комплекса при взаимодействии СО и Н2 с появлением связи С–Н. Образовавшийся первичный комплекс является началом зарождения углеводородной цепочки. Рост цепи происходит путем конденсации и полимеризации. H O H O H C M H C H O H C M M H CH H M + Механизм процесса на железном катализаторе рост углеводородных цепей конденсация H O H C + O H C H H C -H2O M C OH M M M полимеризация 2 CH2 M +2H H3C C OH M H2C CH2 H2C M H C CH 3 M M M … R CH2 CH3 C OH M Механизм процесса на железном катализаторе Завершающая стадия, обрыв цепи, происходит за счет гидрирования или взаимодействия растущей цепи с молекулами продуктов синтеза и последующей десорбции их с поверхности катализатора. Технологические параметры процесса температура не более 250–300 °С; увеличение давления способствует образованию веществ с большей молекулярной массой, а также увеличению степени превращения исходного сырья; уменьшение времени контакта приводит к повышению выхода спиртов, олефинов и углеводородов с короткой цепью. Кинетика процесса Уравнение Уравнение Брютца rk PH2 2 PCO Г. Сторча, Н. Голамбика, Р. Андерсона r авPH2 PCO 2 1 вPH2 PCO 2 Уравнение Уравнение Элиота lg( 1 u ) kP / G Р. Андерсона r kPH 2 θм PH 2 1 aPH 2O / PCO Влияние различных факторов на синтез углеводородов из СО и Н2 Факторы Влияние на синтез Повышение температуры Ускорение реакции, повышение выхода СН4, сильный разогрев катализатора при плохом теплоотводе, снижение выхода углеводородов до 0, резкое увеличение степени конверсии СО по реакции 2СО СО2 + С Повышение Н2 в газе Снижение общего выхода углеводородов, ускорение реакции, повышение выхода СН4 и парафинов Повышение объёмной скорости Снижение выхода углеводородов, повышение выхода газообразных продуктов. Появление спиртов в продуктах реакции Повышение содержания СО в газе Снижение общего выхода углеводородов, замедление скорости реакции, повышение выхода олефинов Увеличение содержания инертных примесей До 15 % – особого эффекта нет, выше 15 % – линейное снижение выхода, повышение содержания газообразных продуктов Перспективы развития процесса синтеза из СО и Н2 Создание таких катализаторов, в присутствии которых, наряду с алифатическими углеводородами нормального строения, образуются ароматические, циклопарафиновые и изопарафиновые углеводороды. Разработка катализаторов прямого синтеза низших олефинов – этилена, пропилена, бутенов, являющихся сырьём для химической и нефтехимической промышленности. Синтез кислородсодержащих соединений, в первую очередь метанола; метанол по ряду важных характеристик превосходит лучшие сорта углеводородных топлив, но недостатки – высокая гидрофильность, токсичность, агрессивность по отношению к некоторым металлам и пластикатам.