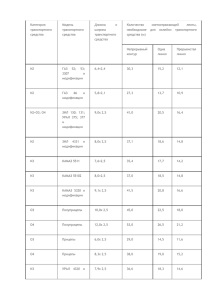
После реакции модификации
реклама

Физико-химические основы биокатализа в иллюстрациях 8. Группоспецифическая химическая модификация. Применение для исследования структуры и функции активных центров ферментов Методы изучения структуры и функций биополимеров и активных центров ферментов Рентгеноструктурный анализ (РСА) – основной на сегодняшний день метод исследования структуры ферментов, Сайт-направленный мутагенез, Химическая модификация и ее более специфический тип – аффинная модификация, Методы, основанные на применении флуоресцентных и спиновых меток. Подбор химических модифицирующих агентов 1. Высказывается предположение об аминокислотных остатках, находящихся в активном центре фермента или интересующем сайте, 2. Осуществляется подбор реагентов, специфичным к определенным аминокислотам, 3. Исследуется ковалентное присоединение реагента к белку и стехиометрия присоединения, 4. Определяется уровень инактивации фермента, как следствие такого воздействия. R R Схема химической модификации. Х – модифицируемый остаток аминокислоты в активном центре, R – химический реагент. Недостаток метода Y R R R Y R После реакции модификации: • Входит ли модифицированный аминокислотный остаток в активный центр фермента? • Важен ли он для активности фермента? После реакции модификации: Анализ образовавшихся продуктов Гидролиз с помощью протеаз Идентификация модифицированного остатка (разделение полученной смеси пептидов) Двумерный электрофорез анализируемый пептид вырезали из геля и секвенировали по Эдману Масс-спектрометрический метод MALDI и его различные разновидности Экспериментальная подготовка образца к идентификации модифицированной части белка с помощью масс-спектрометрического метода MALDI Если инактивация при модификации фермента группоспецифичным реагентом неполная, значит, на поверхности белка есть другие остатки аминокислоты, доступные для модификации, и они функционально важны для протекания ферментативной реакции. Эмпирически показано: при наличии в составе фермента остатков цистеина (Cys) взаимодействие, прежде всего, происходит с Cys в активном центре, потом – с другими остатками Cys, поскольку аминокислоты в активном центре, как правило, более реакционноспособны. Модификация остатков гистидина в активном центре панкреатической рибонуклеазы 2,4-динитрофторбензол (ДНФ) С помощью этого реагента была проведена модификация остатков гистидина (His) в активном центре рибонуклеазы. Было показано, что на 2 М ДНФ приходится 1 М фермента. Позднее было подтверждено с помощью ЯМР, что у рибонуклеазы в активном центре 2 остатка His. Факторы, определяющие реакционную способность функциональных групп биополимеров 1. Общее пространственное экранирование вследствие погруженности функциональной группы внутрь белковой глобулы или образования кoмплекса биополимера с другой макромолекулой. При этом группа недоступна для модификации любыми реагентами или реагентами, размер которых значителен. Например, участие оснований нуклеиновых кислот в стекинг-взаимодействиях делает их менее реакционноспособными, особенно если атака реагентом происходит перпендикулярно плоскости основания. 2. Участие функциональной группы в образовании водородных связей или во взаимодействии с ионами металлов. При этом изменяется ее нуклеофильность. 3. Наличие вблизи функциональной группы электростатически заряженных центров может изменять ее рК. Значение рК аминокислотного остатка в составе активного центра фермента может существенно изменяться под действием окружения и отличаться от рК той же аминокислоты в свободном состоянии. 4. Окружение функциональной группы (аминокислотного остатка), подвергающейся модификации, может влиять на реакцию за счет воздействия на реагент. В некоторых случаях может наблюдаться адсорбция реагента полимером. Пиридоксальфосфат – пример группоспецифического реагента для химической модификации Пиридоксальфосфат - кофермент в реакциях дезаминирования, декарбоксилирования, переаминирования, катализируемых аминотрансферазами, синтетазами, гидроксилазами и другими ферментами, участвующими в метаболизме аминокислот; особенно важна его роль в метаболизме триптофана , глицина , серина , глутаминовой кислоты и серосодержащих аминокислот. Модифицирует белки по α-NH2-группам и ε-NH2группам остатков Lys с образованием основания Шифа. Метод дифференциального мечения Химически неактивные прочно связанные лиганды защищают свой сайт связывания от модификации Реакция идет только по другим реакционноспособным сайтам Ликвидация лиганда с последующей заменой на тот же самый реакционноспособный агент, но в радиоактивной форме, модифицирует только сайт, ранее защищенный лигандом Метод направлен на повышение селективности модификации Недостаток метода: белок может изменять свою конформацию во время дополнительной стадии удаления лиганда из комплекса, что делает выводы менее однозначными. Влияние рК функциональных групп биополимеров на их реакционную способность Изменение рК боковых радикалов аминокислотных остатков вследствие их окружения в составе белков является одним из главных факторов, определяющих их реакционную способность. Например, большинство аминокислот реагируют в непротонированной форме, а значения рК для фyнкциональных групп одинакового строения, в зависимости от их окружения в молекуле белка, могут отличаться на 2 единицы. Пример: модификация остатка серина протеаз, R=-СН2ОН Для модификации гистидина в активном центре протеаз: BrCH2C(O)NH2 BrCH2COOH Br-ацетамид Br-уксусная кислота ICH2C(O)NH2 ICH2COOH I-ацетамид I-уксусная кислота R? Пример: модификация остатка серина протеаз, R=-СН2ОН При рН 6-7 модификации подвергался остаток серина (Ser), хотя при таких значениях рН –ОН группы серина почти не гидролизуются. Cерин изначально проявляет слабую нуклеофильность. В растворе такая реакция не пойдет, а в активном центре нуклеофильность серина существенно повышается при помощи гистидина, оттягивающего на себя протон в паре Ser-His. Ser His A+R A-R d(A - R) K A t R k r dt [H ] K pH-зависимость простой бимолекулярной реакции основной формы нуклеофильной аминокислоты с неионизованным реагентом, где К – константа диссоциации, At – общая концентрация аминокислоты. рН-зависимая константа k΄r задается уравнением: K = krαA k΄r = k r [H ] K наблюдаемая константа скорости при любом рН будет функцией реакционной способности нуклеофила (величина kr) и фракции нуклеофила в непротонированной форме αA=К/([Н+]+К). K = krαA k΄r = k r [H ] K При каждом значении рН k΄r будет расти с ростом К, так как при увеличении константы диссоциации (уменьшении рК) происходит увеличение концентрации нуклеофильной формы аминокислоты. Константа скорости бимолекулярной реакции kr изменяется как функция рК нуклеофильной группы в соответствии с уравнением Бренстеда: logkr = βpK+γ где γ – реакционная константа, зависящая от природы реагента, а β описывает чувствительность в серии нyклеофилов к рК. Выигрываемое за счет увеличения концентрации реакционноспособной формы нуклеофилов ускорение реакции частично компенсируется уменьшением kr. Величина β обычно близка к 0,5, и происходит общее увеличение скорости, особенно если рН реакционной смеси находится вблизи рК ионизуемой группы. Выбор реагентов и реакционных условий для модификации биополимеров Условие: биополимеры должны быть в нативной, "физиологически активной" форме. Это накладывает серьезные ограничения на возможность применения для модификации биополимеров различных реагентов. Необходимо: знать механизм реакции модификации уметь идентифицировать продукты реакции, то есть определять степень модификации различных участков молекулы биополимера. Определение уровня модификации удобнее всего при использовании реагентов, несущих «метку», например, радиоактивную. Прямым путем определения положения модифицированных звеньев в структуре биополимеров является анализ их первичной структуры, то есть гидролиз биополимера и идентификация модифицированных остатков. Исчерпывающая модификация функциональных групп биополимера в условиях, стабилизирующих его пространственную структуру Предполагают, что потенциально реакционноспособные «экспонированные» участки молекулы модифицируются количественно, а «экранированные» участки не модифициpуются при выходе на плато кинетической кривой реакции модификации. «Экспонированные» – реагирующие в данных условиях функциональные группы. «Экранированные» – любые не реагирующие функциональные группы. Недостатки: необходимо проводить модификацию на большую глубину. теряется информация о различиях в реакционной способности "экспонированных" групп – они подвергаются полной модификации. при глубокой модификации биополимера могут происходить изменения его структуры, сопровождающиеся модификацией групп, которые "экранированы" в нативной молекуле. Определение начальных скоростей модификации функциональных групп биополимеров • Начальные скорости определяются при малых глубинах модификации и могут служить количественными характеристиками реакционной способности функциональных групп в нативной, не измененной модификацией, структуре биополимера. • Этот подход позволяет избежать осложнений, возникающих за счет повреждений структуры биополимера при глубокой модификации. • Применение такого подхода связано с определением количеств отдельных модифицированных остатков в составе биополимера при глубине модификации биополимера около 1 эквивалента реагента на моль биополимера. Эта сложная задача может быть решена с помощью специальных методов анализа, обладающих высоким разрешением. Пример модификации реагентом, содержащим азидогруппу N-(4-азидо-2-нитрофенил)-2-аминоэтилсульфонат применяемый для модификации рибонуклеазы (РНК-азы) При облучении реакционной смеси из азидогруппы генерируются высокореакционноспособные нитрены. Такой реагент способен модифицировать максимальное количество функциональных групп биополимеров. Данный подход применим для изучения структуры и конформационных изменений биополимеров, так как, применяя соответствующие реагенты, можно проводить реакцию со скоростью, превосходящей скорость конформационного превращения белка. Модификация биополимеров бифункциональными реагентами Реагенты, содержащие две модифицирующие группировки, способны присоединяться к двум сближенным группам в составе одного белка или молекулы нуклеиновой кислоты или образовывать ковалентные связи с двумя молекулами биополимеров, соединяя их ковалентно. Расстояние между функциональными группами, подвергающимися модификации одной молекулой реагента, ограничено его длинной. Поэтому исследование модификации с помощью бифyнкциональных реагентов различной длины позволяет получить информацию о взаимном расположении различных функциональных групп в составе биополимеров, макромолекул в сложных комплексах (рибосомы, хроматин) или в клеточных структурах (например, белки в мембранах) или даже об организации ферментных комплексов внутри живой клетки. Бифyнкциональные реагенты Содержат две одинаковые реакционноспособные группы Модификация осуществляется простой обработкой исследуемого биополимера или макромолекулярного комплекса с помощью реагента Гетерофункциональные содержат две реакционноспособные группы различной специфичности Модификация осуществляется последовательно Реагент может быть сначала присоединен к одной из макромолекул. Затем после помещения биополимера в какие-то новые условия проводится модификация второй функциональной группой Примеры бифункциональных реагентов диимидоэфиры 1,5-дифтор-2,4-динитро-бензол Пример гетерофункциональных реагентов Реагенты содержат азидогруппы и группы, специфично модифицирующие аминогруппы или SH-гpyппы Первоначально можно присоединить эти реагенты к определенным точкам в структуре белка за счет светонезависимых специфичных реакций. Затем может быть проведена активация азидогрyпп реагента. При этом будут происходить реакции в окрестности модифицированной аминогрyппы или SH –группы. Расщепляемые бифyнкциональные реагенты Содержат между реакционноспособными группами специальную структуру, которая позволяет расщепить реагент на две части после проведения модификации. В качестве таких структур используют, например, дисульфидную связь, которая может быть разрушена окислением или восстановлением: Или цис-гликольную группировку, которую можно разрушить окислением перйодатом. Примером могут служить реагенты общей формулы, применявшиеся для модификации рибосом: При модификации диэпоксибутаном цис-гликольная группировка возникает при реакции: Идентификация продуктов модификации в случае применения расщепляемых реагентов с помощью «диагональных методов», например, диагонального электрофореза Смесь модифицированных белков разделяют электрофорезом в одном направлении. Затем белки, не извлекая их из геля, подвергают расщеплению с помощью процедуры, разрушающей реагент. После этого проводят электрофорез во втором направлении в условиях, идентичных условиям разделения в первом направлении. Неизмененные белки – на диагонали геля. Белки, вновь образовавшиеся при расщеплении реагента, соединяющего их в агрегат, будут находиться в стороне от диагонали, так как отличаются по подвижности от белка, в составе которого они были во время первого разделения.